Trong phản ứng với chất nào, H2O2 thể hiện là chất oxi hoá?
H2O2 có tính oxi hóa khi tác dụng với chất khử. Các chất: dung dịch KMnO4, dung dịch H2SO4 đặc và O3 chỉ có tính oxi hóa
=> H2O2 tác dụng với dung dịch H2SO3 thể hiện là chất oxi hóa
H2O2 + H2SO3 → H2SO4 + H2O
Cho phản ứng: 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O. Hệ số tỉ lượng đúng ứng với chất oxi hoá và chất khử là:
Chất oxi hóa là KMnO4 và chất khử là H2O2
=> Hệ số tỉ lượng đúng ứng với chất oxi hoá và chất khử là: 2 và 5
Trong phản ứng nào sau đây H2O2 đóng vai trò chất khử?
H2O2 đóng vai trò chất khử khi tác dụng với chất oxi hóa => nguyên tử O trong H2O2 có số oxi hóa tăng tạo thành O2 => chỉ có phản ứng : H2O2 + Cl2 → O2 + HCl thỏa mãn
Trong số các chất sau, chất nào có thể tác dụng với dung dịch KI tạo I2?
Chất có thể tác dụng với dung dịch KI tạo I2 là O3 và Cl2
2KI + O3 + H2O → I2 + 2KOH + O2
2KI + Cl2 → 2KCl + I2
Chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
Chất vừa có tính oxi hóa, vừa có tính khử là H2O2
O3, H2SO4 đặc, SO3 chỉ có tính oxi hóa
Đốt 13 gam bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam (giả sử hiệu suất phản ứng là 100%). Kim loại đó là
Gọi kim loại là R có hóa trị là n
Bảo toàn khối lượng: \({{m}_{R}}+{{m}_{{{O}_{2}}}}={{m}_{X}}=>{{m}_{{{O}_{2}}}}=16,213=3,2\text{ }gam\)
=> nO2 = 0,1 mol
4R + nO2 → 2R2On
$\frac{{0,4}}{n}$ ← 0,1
$ = > {\text{ }}{M_R} = \frac{{13}}{{\frac{{0,4}}{n}}} = 32,5n$
Với n = 2 => R = 65 => R là kim loại Zn
Đốt cháy hoàn toàn 17,4 gam hỗn hợp gồm Mg và Al trong khí oxi dư thu được 30,2 gam hỗn hợp oxit. Thể tích khí oxi (đktc) đã phản ứng là
Bảo toàn khối lượng: ${m_{KL}} + {m_{{O_2}}} = {m_{oxit}} = > {m_{{O_2}}} = 30,2 - 17,4 = 12,8\,\,gam$
$ = > {\text{ }}{n_{{O_2}}} = 0,4{\text{ }}mol = > \,\,{V_{{O_2}}} = 8,96$ lít
Nung 0,2 mol KMnO4 ở nhiệt độ cao thu được chất rắn X và 1,68 lít khí O2 (đktc). Cho chất rắn X vào dung dịch HCl đặc, dư thu được V lít khí Cl2 (đktc). Giá trị của V là
2KMnO4 → K2MnO4 + MnO2 + O2
=> Chất rắn X gồm K2MnO4, MnO2 và KMnO4 còn dư
=> Cho chất rắn X vào dung dịch HCl đặc thu được muối là KCl, MnCl2
Bảo toàn electron: $5.{n_{KMn{O_4}}} = 4.{n_{{O_2}}} + 2.{n_{C{l_2}}} = > \,\,{n_{C{l_2}}} = 0,35\,\,mol$
$ = > {\text{ }}{{\text{V}}_{C{l_2}}} = {\text{ }}0,35.22,4 = 7,84\,\,lít $
Tiến hành nhiệt phân hoàn toàn 15,8 gam KMnO4, sau đó cho toàn bộ lượng khí O2 thu được tác dụng với hỗn hợp X gồm Cu, Fe thu được 13,6 gam hỗn hợp Y. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch H2SO4 đặc, nóng dư thu được 3,36 lít SO2 (đktc). Phần trăm khối lượng Fe trong hỗn hợp X là
2KMnO4 → K2MnO4 + MnO2 + O2
0,1 mol → 0,05 mol
Gọi nFe = x mol; nCu = y mol
Bảo toàn khối lượng: ${m_{Fe}} + {m_{Cu}} + {m_{{O_2}}} = {m_{oxit}}$
$ = > {m_{{\text{Fe}}}} + {m_{Cu}} = 13,6 - 0,05.32 = 12\,\,gam$
=> 56x + 64y = 12 (1)
Xét toàn bộ quá trình có Fe và Cu cho e, O2 và H2SO4 nhận e
Bảo toàn e: $3.{n_{Fe}} + 2.{n_{Cu}} = 4.{n_{{O_2}}} + 2.{n_{S{O_2}}}$
=> 3x + 2y = 4.0,05 + 2.0,15 (2)
Từ (1) và (2) => x = 0,1 mol; y = 0,1 mol
=> %mFe = 0,1.56 / 12 = 46,67%
Đốt cháy hoàn toàn 13 gam bột một kim loại hóa trị II trong oxi dư, thu được chất rắn X có khối lượng 16,2 gam. Kim loại đó là
Đặt kim loại hóa trị II là A
PTHH: 2A + O2 \(\xrightarrow{{{t^0}}}\) 2AO
BTKL ta có: mO2 = mAO – mA = 16,2 – 13 = 3,2 (g)\( \Rightarrow {n_{{O_2}}} = \frac{{{m_{{O_2}}}}}{{{M_{{O_2}}}}} = \frac{{3,2}}{{32}} = 0,1\,(mol)\)
Theo PTHH: nA = 2nO2 = 2.0,1 = 0,2 (mol)
Ta có: \({M_A} = \frac{{{m_A}}}{{{n_A}}} = \frac{{13}}{{0,2}} = 65\,(g/mol)\)
⟹ A là kẽm (Zn)
Đốt cháy hoàn toàn 9,4 gam hỗn hợp ancol etylic C2H5OH và ancol metylic CH3OH (tỉ lệ số mol lần lượt là 2: 3) cần dùng bao nhiêu lít khí oxi ở đktc. Biết sản phẩm sau phản ứng thu được chỉ gồm CO2 và H2O?
Đặt số mol C2H5OH = 2x (mol) ⟹ số mol CH3OH = 3x (mol)
Có: mC2H5OH + mCH3OH = 9,4
⟹ 2x.46 + 3x.32 = 9,4
⟹ 188x = 9,4
⟹ x = 0,05
⟹ C2H5OH: 0,1 (mol); CH3OH: 0,15 (mol)
Xét đốt cháy:
C2H6O + 3O2 \(\xrightarrow{{{t^0}}}\) 2CO2 + 3H2O (1)
0,1 → 0,3 (mol)
CH4O + 3/2O2 \(\xrightarrow{{{t^0}}}\) CO2 + 2H2O (2)
0,15 → 0,225 (mol)
∑nO2(1)+(2) = 0,3 + 0,225 = 0,525 (mol) ⟹ VO2(đktc) = 0,525×22,4 = 11,76 (lít)
Hỗn hợp O2 và O3 có tỉ khối đồi với H2 bằng 20. Phần trăm số mol O2 và O3 lần lượt là (cho biết H = 1; O = 16)
Mhh = 20. MH2 = 20.2 = 40 (g/mol)
Đặt số mol O2 = a(mol) ; số mol O3 = b (mol)
Áp dụng công thức tính phân tử khối trung bình ta có:
\(\begin{array}{l}{M_{hh}} = \frac{{{n_{{O_2}}}.{M_{{O_2}}} + {n_{{O_2}}}.{M_{{O_3}}}}}{{{n_{{O_2}}} + {n_{{O_3}}}}}\\ \Rightarrow 40 = \frac{{32a + 48b}}{{a + b}}\\ \Rightarrow 40a + 40b = 32a + 48b\\ \Rightarrow 8a = 8b\\ \Rightarrow a = b\end{array}\)
Vậy trong hh có nO2 = nO3 → Phần trăm số mol O2 = O3 = 50%
Trong phòng thí nghiệm điều chế oxi bằng phản ứng nhiệt phân KClO3. Nếu dùng 12,25 gam KClO3 thì sau phản ứng hoàn toàn, thể tích O2 thu được (đktc) là
Ta có: nKClO3 = 12,25 : 122,5 = 0,1 mol
PTHH: 2KClO3 \(\xrightarrow{{{t^0}}}\) 2KCl + 3O2
Theo PTHH → nO2 = 1,5.nKClO3 = 0,15 mol
→ VO2 = 0,15.22,4 = 3,36 lít
Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là:
Theo bảo toàn khối lượng ta có mX = mZ - mY = 60,2 - 22,2 = 37,8 (gam)
Đặt số mol Cl2 là x mol; số mol O2 là y mol.
Ta có: x + y = nX = 0,7 mol và mX = 71x + 32y = 38 gam
Giải hệ trên ta có x = 0,4 và y = 0,3
Gọi số mol Mg là a mol; số mol Al là b mol → 24a + 27b = 22,2 (1)
Các quá trình cho e:
Mg0 → Mg+2 + 2e
Al0 → Al+3 + 3e
Các quá trình nhận e:
Cl2 + 2e → 2Cl-
O2 + 4e → 2O-2
Theo bảo toàn electron ta có 2.nMg + 3.nAl = 2.nCl2 + 4.nO2 → 2a + 3b = 2. 0,4 + 4.0,3 = 2 (mol) (2)
Giải hệ (1) và (2) ta có a = 0,7 và b = 0,2
Phần trăm khối lượng của Al trong Y là: %mAl =0,2.27.100%/22,2 = 24,32%
Phóng điện qua O2 được hỗn hợp khí X có khối lượng mol trung bình là 40 g/mol. Hiệu suất của phản ứng ozon hóa là
Chọn số mol O2 ban đầu là 1 mol → mO2 bđ = 32 (g)
Đặt số mol O2 pư = 3a (mol)
\(3{O_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{O_3}\)
nbđ 1 (mol)
npư 3a → 2a (mol)
nsau 1 – 3a 2a (mol)
BTKL ta có: mX = mO2bđ = 32 (g) ⇒ \({n_X} = \frac{{32}}{{40}} = 0,8(mol)\)
∑ nX = nO2 dư + nO3 = 1 – 3a + 2a
= 1 – a (mol)
→ 1 –a = 0,8
→ a = 0,2 (mol)
Hiệu suất của phản ứng là: \(\% H = \frac{{{n_{{O_2}pu}}}}{{{n_{{O_2}\,bd}}}}.100\% = \frac{{0,2.3}}{1}.100\% = 60\% \)
Cho V lít hỗn hợp khí X gồm O2 và O3. Sau một thời gian ozon bị phân hủy hết, thu được chất khí duy nhất Y và thể tích khí tăng lên 5% so với thể tích ban đầu, biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất. Phần trăm thể tích của O3 trong hỗn hợp ban đầu là
Chọn hh X ban đầu = 1 (mol); Đặt số mol O3 phân hủy = x (mol)
Cùng điều kiện về nhiệt độ và áp suất thì tỉ lệ thể tích tương ứng với tỉ lệ về số mol
nkhí tăng = 5%nX = 0,05.1 = 0,05 (mol)
\(2{O_3} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3{O_2}\)
(mol) x 1,5x
⇒ V tăng = VO2 sinh ra – VO3 mất đi = 1,5x – x = 0,5x (mol)
→ 0,5x = 0,05
→ x = 0,1
→\(\% {V_{{O_3}}} = \frac{{{n_{{O_3}}}\,}}{{{n_{hh}}}}.100\% = \frac{{0,1}}{1}.100\% = 10\% \)
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 18. Đốt cháy hoàn toàn 4,48 lít khí C2H4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Giá trị của V là
\({d_{X/{H_2}}} = {{{M_X}} \over {{M_{{H_2}}}}} \Rightarrow {M_X} = 18.2 = 36\;(g/mol)\)
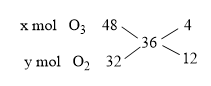
\( \Rightarrow {x \over y} = {4 \over {12}} = {1 \over 3}{\rm{ }} \Rightarrow {\rm{3x = y }}(1)\)
C2H4 \(\buildrel {{t^0}} \over\longrightarrow \) 2CO2 + 2H2O
0,2 0,4 0,4
BTNT O: nO trước = \(2{n_{{O_2}}} + 3{n_{{O_3}}}\)= 2y + 3x
nO sau = \(2{n_{C{O_2}}} + {n_{{H_2}O}}\)= 2.0,4 + 0,4 = 1,2
→ 3x + 2y = 1,2 (2)
Giải (1) và (2) ta được: \(x = {2 \over {15}};y = {2 \over 5} \Rightarrow {V_X}_{(dktc)} = ({2 \over {15}} + {2 \over 5}).22,4 \approx 11,95(l)\)
Oxi hóa hoàn toàn 9,1 gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được m gam hỗn hợp Y gồm các oxit. Giá trị của m là
Đặt: nCu = nAl = x(mol)
Ta có: 64x + 27x = 9,1 ⇒ x = 0,1 (mol)
2Cu + O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2CuO
(mol) 0,1 → 0,1
4Al + 3O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2Al2O3
(mol) 0,1 → 0,05
→ m = mCuO + mAl2O3 = 0,1.80 + 0,05.102 = 13,1 (gam)
Cho m gam Fe tác dụng hết với O2 thu được 46,4 gam Fe3O4. Tìm giá trị của m
\(3Fe + 2{O_2}\xrightarrow{{{t^0}}}F{e_3}{O_4}\)
\({n_{Fe}} = 3{n_{F{e_3}{O_4}}} = 3.\frac{{46,4}}{{232}} = 0,6(mol) \Rightarrow {m_{Fe}} = 0,6.56 = 33,6(g)\)
Chuyển hóa hoàn toàn 7,2 gam O3 thu được V lít O2 (đktc). Giá trị của V là
nO3 = 7,2 : 48 = 0,15 (mol)
\(2{O_3}\,\,\underset{{}}{\overset{{t,p,xt}}{\longleftrightarrow}}\,\,\,3{O_2}\,\)
\({n_{{O_2}}} = \frac{3}{2}{n_{{O_3}}} = \frac{3}{2}.0,15 = 0,225(mol) \Rightarrow {V_{{O_2}(dktc)}} = 0,225.22,4 = 5,04(lit)\)

