Nguyên tố Y là phi kim thuộc chu kì 2 của BTH, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO2. Hợp chất tạo bởi Y và kim loại M là MY2 trong đó Y chiếm 37,5% về khối lượng. M là
*Xác định Y:
Y thuộc chu kì 2 => Y có 2 lớp e
Công thức oxit cao nhất của Y là YO2 => Y có hóa trị IV => Y thuộc nhóm IVA => Y có 4e lớp ngoài cùng
=> Cấu hình e của Y: 1s22s22p2 => Y là Cacbon
*Xác định M: Hợp chất MC2: \(\% {m_C} = \dfrac{{2.12}}{{M + 2.12}}.100\% = 37,5\% \to M = 40(Ca)\)
Vậy M là Ca
Các nguyên tố ở chu kỳ 2 được sắp xếp theo chu kỳ giá trị độ âm điện giảm dần (từ trái sang phải như sau):
Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện của các nguyên tố tăng dần do đó độ âm điện: Li < Be < B < C < N < O < F
Phát biểu nào sau đây là sai?
C sai vì trong cùng một chu kì, theo chiều tăng dần của đơn vị điện tích hạt nhân thì bán kính nguyên tử của các nguyên tố giảm dần.
Nguyên tử các nguyên tố halogen được sắp xếp theo hiều bán kính nguyên tử giảm dần (từ trái sang phải):
Các nguyên tố trên đều thuộc cùng một nhóm A. Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố tăng dần. Do đó ta có sự sắp xếp bán kính theo chiều giảm dần là: I > Br > Cl > F
Bán kính nguyên tử của các nguyên tố: 3Li, 11Na, 8O, 9F được xếp theo thứ tự tăng dần trừ trái sang phải là
- Cấu hình e nguyên tử: 3Li (1s22s1), 11Na(1s22s22p63s1), 8O (1s22s22p4), 9F (1s22s22p5)
- Vị trí tương đối của các nguyên tố trong BTH:
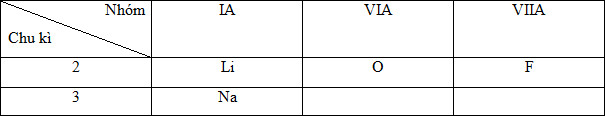
- Theo quy luật biến đổi bán kính:
+ Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố giảm dần.
+ Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố tăng dần.
Ta có sự sắp xếp bán kính như sau: F < O < Li < Na
Nguyên tố X có cấu hình e là : 1s22s22p63s23p3. Kết luận không đúng là :
C. Số electron lớp ngoài cùng của X bằng 3 nên X thuộc nhóm III A trong bảng hệ thống tuần hoàn
Sai : số electron lớp ngoài cùng là 5 chứ không phải 3
Cho hình vẽ biểu diễn kích thước của các nguyên tử Na, K, F, Cl dưới đây:

Biết số thứ tự của Na, K, F, Cl trong bảng tuần hoàn hoá học lần lượt là 11, 19, 9, 17. Phát biểu nào sau đây đúng?
Cấu hình nguyên tử của
- Na (Z=11): 1s22s22p63s1 => Nhóm IA, chu kì 3
- K (Z=19): 1s22s22p63s23p64s1 => Nhóm IA, chu kì 4
- F (Z=9): 1s22s22p5 => Nhóm VIIA, chu kì 2
- Cl (Z=17): 1s22s22p63s23p5 => Nhóm VIIA, chu kì 3
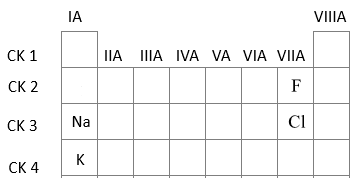
- Trong cùng 1 nhóm A theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử tăng dần
=> \({r_{Na}} < {r_K}\) và \({r_F} < {r_{Cl}}\) (1)
- Trong cùng 1 chu kì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần
=> \({r_{Cl}} < {r_{Na}}\)(2)
Từ (1) và (2) => \({r_F} < {r_{Cl}} < {r_{Na}} < {r_K}\)
=> X là F, Y là Cl, Z là Na và T là K
Cho bảng tuần hoàn mô phỏng dưới đây:

Cho các phát biểu sau:
(a) A và D đều có 3 lớp electron.
(b) B, C đều tạo với oxygen hợp chất có dạng X2O.
(c) A có 4 electron lớp ngoài cùng và có 2 lớp electron.
(d) E có 4 electron lớp ngoài cùng và có ba lớp electron.
(e) D và E đều tạo với hydrogen hợp chất có dạng RH.
Số phát biểu đúng là
(a) sai. A nằm ở chu kì 3 có 3 lớp electron. D nằm ở chu kì 2 có 2 lớp electron
(b) đúng vì B và C đều thuộc nhóm IA
(c) sai. A thuộc chu kì 3, nhóm IVA => A có 3 lớp electron và có 4 electron lớp ngoài cùng
(d) sai. A có 3 lớp electron và có 4 electron lớp ngoài cùng
(e) sai. E có 3 lớp electron và 7 electron lớp ngoài cùng
Cho các nguyên tử X, Y, Z, T thuộc cùng một chu kỳ và thuộc cùng nhóm A trong bảng tuần hoàn hoá học. Bán kính nguyên tử của các nguyên tố được biểu diễn như hình sau:
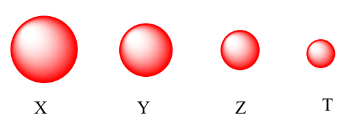
Nguyên tử có độ âm điện nhỏ nhất là
Các nguyên tố có cùng số lớp electron thì được xếp vào cùng một chu kỳ
Trong một chu kỳ theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử càng nhỏ thì độ âm điện càng mạnh
=> Nguyên tử có độ âm điện nhỏ nhất là X
Cho các nguyên tử X, Y, Z, T thuộc nhóm IA có bán kính trung bình như hình vẽ dưới đây:

Chiều sắp xếp tăng dần tính kim loại là
Trong một nhóm A theo chiều tăng dần điện tích hạt nhân, tính kim loại và bán kính nguyên tử tăng dần
=> Vị trí của các nguyên tử X, Y, Z, T trong nhóm IA theo chiều tăng dần điện tích hạt nhân là T, Z, Y, Z
=> Chiều tăng dần về tính kim loại là T, Z, Y, X
Cho biết độ âm điện của các nguyên tử từ X đến T thuộc chu kì 2 và 3 của bảng tuần hoàn các nguyên tố hoá học trong hình dưới đây:

X và Y là các nguyên tố thuộc nhóm IVA, Z và T là các nguyên tố thuộc nhóm VIIA. Phát biểu nào sau đây đúng?
Theo bài có:
- X và Y đều thuộc nhóm IVA, từ hình minh hoạ có độ âm điện của X nhỏ hơn của Y => X thuộc chu kì 3, Y thuộc chu kì 2
- Z và T đều thuộc nhóm VIIA, từ hình minh hoạ có độ âm điện của Z nhỏ hơn của T => Z thuộc chu kì 3, T thuộc chu kì 2
A đúng
B sai. Y thuộc nhóm IVA => Y tạo được hidroxit ứng với oxit cao nhất là H2YO3
C sai. Z thuộc chu kì 3, T thuộc chu kì 2 => Bán kính nguyên tử của Z lớn hơn T
D sai
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn các nguyên tố hoá học. Oxide của X tan trong nước tạo thành một dung dịch làm quỳ tím hoá đỏ. Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh. Oxide của Z phản ứng được với cả acid lẫn kiềm. Dãy các nguyên tố được sắp xếp theo chiều tăng dần số hiệu nguyên tử từ trái sang phải là
- Oxide của X tan trong nước tạo thành dung dịch làm quỳ tím hoá đỏ => Hydroxide của X có tính acid => X là 1 phi kim
- Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh => Hydroxide của Y có tính base => Y là một kim loại
- Z phản ứng được với cả acid lẫn kiềm và X, Y, Z thuộc cùng 1 chu kì => Tính kim loại giảm dần theo thứ tự Y, Z, X
- Theo bài có X, Y, Z thuộc cùng 1 chu kì. Theo quy luật tuần hoàn, theo chiều tăng dần số hiệu nguyên tử thì tính kim loại tăng dần
=> Thứ tự tăng dần số hiệu nguyên tử là Y, Z, X
Mô hình dưới dây biểu diễn sự sắp xếp electron của nguyên tử nguyên tố X đến nguyên tố T ở trạng thái cơ bản

Cho các phát biểu sau:
(a) Cả 4 nguyên tố đều thuộc cùng một chu kì trong bảng tuần hoàn.
(b) Nguyên tử của nguyên tố Y có 5 orbital chứa electron.
(c) Nguyên tố Y có bán kính nguyên tử nhỏ hơn nguyên tố T.
(d) Bán kính anion T- lớn hơn cation X+.
Số phát biểu đúng là
(a) đúng vì cả 4 nguyên tố đều có cùng số lớp electron
(b) sai. Cấu hình electron nguyên tử của Y là 1s22s22p2
Biểu diễn bằng cấu hình orbital nguyên tử:
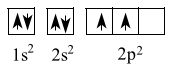
=> Nguyên tố Y có 4 orbital nguyên tử chứa electron
(c) sai
Có 4 nguyên tố trên đều cùng thuộc một chu kì. Thứ tự sắp xếp theo chiều tăng dần số đơn vị điện tích hạt nhân là Y, Z, X, T
Trong một chu kì theo chiều tăng dần số đơn vị điện tích hạt nhân, bán kính nguyên tử giảm dần
=> Thứ tự giảm dần về bán kính nguyên tử là Y>Z>X>T
=> Y có bán kính nguyên tử lớn hơn T
(d) đúng
Có các bán phản ứng sau:
\(X \to {X^ + } + 1e\) => Để tạo thành X+ thì X mất đi 1 electron => X+ có 2 lớp electron
\(T + 1e \to {T^ - }\) => Để tạo thành T- thì T thêm 1 electron => T- có 3 lớp electron
=> T- có bán kính nguyên tử lớn hơn X+
=> Số phát biểu đúng là 2
Cho mô hình cấu tạo của 4 nguyên tố dưới đây:
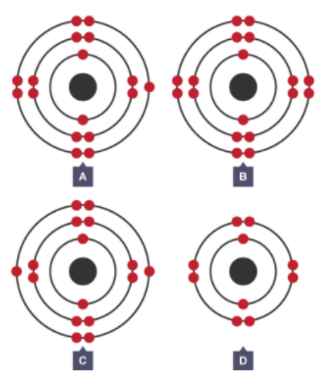
Số nguyên tố phi kim là
A có 7 electron lớp ngoài cùng => A là phi kim
B có 8 electron lớp ngoài cùng => B là khí hiếm
C có 6 electron lớp ngoài cùng => C là phi kim
D có 8 electron lớp ngoài cùng => D là khí hiếm
=> Có 2 nguyên tố phi kim
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
Từ Li đến F, các nguyên tố thuộc cùng chu kì, điện tích tăng dần thì bán kính nguyên tử giảm, độ âm điện tăng.
Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì
A đúng vì: Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì bán kính nguyên tử tăng dần, độ âm điện giảm dần, tính kim loại tăng dần, tính phi kim giảm dần.
Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang
3Li: 1s22s1 → chu kì 2, nhóm IA
8O: 1s22s22p4 → chu kì 2, nhóm VIA
9F: 1s22s22p5 → chu kì 2, nhóm VIIA
11Na: 1s22s22p63s1 → chu kì 3, nhóm IA
→ Vị trí các nguyên tố trong bảng tuần hoàn theo sơ đồ sau:

→ Bán kính nguyên tử tăng dần: F < O < Li < Na
Anion ${X^ - }$ và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
${X^ - }$ : [Ne]3s23p6 $ \to $ X: [Ne]3s23p5 (Z = 17) $ \to $ X có số thứ tự 17, chu kì 3, nhóm VIIA
Y2+: [Ne]3s23p6 $ \to $ Y: [Ar]4s2 (Z = 20) $ \to $ X có số thứ tự 20, chu kì 4, nhóm IIA
Cấu hình electron của ion X3+ là 1s22s22p63s23p63d5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
X3+: 1s22s22p63s23p63d5
Vì nguyên tử X mất 3e tạo thành ion X3+
=> Cấu hình X: 1s22s22p63s23p63d64s2
$ \to $ X thuộc chu kì 4, nhóm VIIIB
Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Vị trí (chu kỳ, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là
Ta có: Tổng số hạt của nguyên tử là 52 => p +n + e =52
Mà p = e = Z
=> 2Z + n = 52 (1)
Số n nhiều hơn số p là 1 hạt => n - Z = 1 (2)
Từ (1) và (2) ta có hệ:
\(\left\{ \begin{array}{l}2Z{\rm{ }} + {\rm{ }}n{\rm{ }} = {\rm{ }}52\\n{\rm{ }} - {\rm{ }}Z{\rm{ }} = {\rm{ }}1{\rm{ }}\end{array} \right.\) => \(\left\{ \begin{array}{l}{\rm{Z }} = {\rm{ 17}}\\{\rm{n }} = {\rm{ 18 }}\end{array} \right.\)
=> Cấu hình electron của X: \({\rm{[}}Ne{\rm{]}}3{s^2}3{p^5}\)
=> X thuộc chu kì 3, nhóm VIIA

