Hình vẽ dưới mô tả sự ảnh hưởng của yếu tố nào đến tốc độ phản ứng giữa X với Y?

Sự khác nhau giữa hình a) và hình b) là kích thước của chất Y. Khi chất Y bị chia nhỏ ra thì khả năng va chạm với X lớn hơn (hình b) còn chất Y không bị chia nhỏ thì khả năng va chạm với X ít hơn (hình a)
=> Yếu tố ảnh hưởng đến tốc độ phản ứng là diện tích tiếp xúc
Cho phản ứng: \(CaC{O_3}(s) + 2HCl(aq) \to CaC{l_2}(aq) + C{O_2}(g) + {H_2}O(aq)\) và các biện pháp sau:
(1) Tăng nồng độ dung dịch HCl.
(2) Tăng áp suất.
(3) Giảm nhiệt độ.
(4) Nghiền nhỏ CaCO3.
Số biện pháp làm tăng tốc độ phản ứng là
Khi tăng các yếu tố là nồng độ, nhiệt độ, áp suất, bền mặt tiếp xúc thì làm tăng số va chạm hiệu quả, dẫn đến tốc độ phản ứng tăng.
Riêng áp suất chỉ đúng với phản ứng có chất khí, nhưng với trường hợp này chỉ có chất khí sinh ra nên áp suất không làm ảnh hưởng đến tốc độ phản ứng
=> Các biện pháp làm tăng tốc độ phản ứng: (1), (4)
Cho phương trình hóa học của phản ứng: \(2CO(g) + {O_2}(g) \to 2C{O_2}(g)\). Nếu hệ số nhiệt độ Van’t Hoff bằng 2, tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ của phản ứng từ 80oC xuống 50oC?
Ta có t2=50oC, t1=80oC
Áp dụng công thức: \(\dfrac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = {\gamma ^{\dfrac{{{t_2} - {t_1}}}{{10}}}} = {2^{\dfrac{{50 - 80}}{{10}}}} = {2^{ - 3}} = 1/8\)
Tốc độ phản ứng giảm 8 lần khi giảm nhiệt độ của phản ứng từ 80oC xuống 50oC
Cho phương trình phản ứng tổng hợp phosgene (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất sau:
\(CO + C{l_2} \to COC{l_2}\)
Phương trình tốc độ phản ứng được xác định từ thực nghiệm có dạng như sau:
\(v = k.{C_{CO}}.C_{C{l_2}}^{3/2}\)
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ Cl2 lên 3 lần?
Gọi nồng độ ban đầu của CO và Cl2 lần lượt là \({C_{CO}}\)và \({C_{C{l_2}}}\)=> \(v = k.{C_{CO}}.C_{C{l_2}}^{3/2}\)
Khi tăng nồng độ Cl2 lên 3 lần tức có \(3{C_{C{l_2}}}\)=> \(v' = k.{C_{CO}}.{(3{C_{C{l_2}}})^{3/2}} \simeq 5,2k{C_{CO}}.C_{C{l_2}}^{3/2} = 5,2v\)
=> Khi tăng nồng độ Cl2 lên 3 lần thì tốc độ phản ứng tăng lên khoảng 5,2 lần
Chất độc màu da cam đioxin gây tác hại vô cùng nghiêm trọng đối với môi trường và sức khỏe con người. Nó phân hủy vô cùng chậm trong đất. Nghiên cứu cho thấy phải mất tám năm để lượng đioxin trong đất giảm đi một nửa. Nếu một mảnh đất có chứa 0,352 mg đioxin thì sau bao lâu lượng đioxin còn lại là 2,2.10-5 g đioxin?
Từ 0,352 mg đioxin phân hủy còn lại là 2,2.10-5 g đioxin tức đã giảm \(\dfrac{{0,{{352.10}^{ - 3}}}}{{2,{{2.10}^{ - 5}}}} = 16 = {2^4}\) lần
=> Thời gian cần thiết để 0,352 mg đioxin phân hủy còn lại là 2,2.10-5 g đioxin là 8.4=32 năm
Cho đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước như sau:
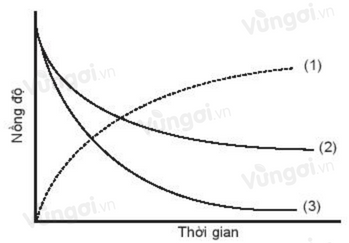
Đường cong nào là của oxygen?
PTHH: \({O_2} + 2{H_2} \to 2{H_2}O\)
Nhận thấy O2 và H2 là các chất tham gia phản ứng nên nồng độ theo thời gian sẽ giảm
Theo PTHH số phân tử O2 tham gia phản ứng ít hơn số phân tử H2 nên số va chạm hiệu quả với H2 để tạo thành H2O ít hơn => Sự giảm nồng độ theo thời gian của O2 chậm hơn so với H2 => Tương ứng với đường cong (2)
Cho phản ứng A + 2B → C
Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k = 0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng là:
V = k. [A] . [B]2
20 % chất A tham gia phản ứng => có : 1. 20 : 100 = 0,2 M đã tham gia phản ứng
A + 2B → C
0,2 => 0,4
=> Nồng độ A còn : 1- 0,2 = 0,8
=> Nồng độ B còn : 3- 0,4 = 2,6
V = 0,5 . 0,8 . 2,62 = 2,704
Cho phản ứng sau: \(3{I^ - }(aq) + {S_2}{O_8}^{2 - }(aq) \to {I_3}^ - (aq) + 2S{O_4}^{2 - }(aq)\). Kết quả nghiên cứu động học của phản ứng được cho trong bảng dưới đây:

Công thức tính tốc độ của phản ứng trên có dạng là
Theo định luật tác dụng khối lượng có: \(v = k.{[{I^ - }{\rm{]}}^a}.{{\rm{[}}{S_2}{O_8}^{2 - }{\rm{]}}^b}\)
Thay các giá trị tương ứng vào công thức trên ta được:
\({v_1} = k.{(0,001)^a}.{(0,001)^b}\)
\({v_2} = k.{(0,002)^a}.{(0,001)^b}\)
\({v_3} = k.{(0,002)^a}.{(0,002)^b}\)
=> \(\dfrac{{{v_2}}}{{{v_1}}} = {2^a} = 2 \Rightarrow a = 1\); \(\dfrac{{{v_3}}}{{{v_2}}} = {2^b} = 2 \Rightarrow b = 1\)
=> Biểu thức định luật tốc độ phản ứng là \(v = k.{\rm{[}}{I^ - }{\rm{]}}.{\rm{[}}{S_2}{O_8}^{2 - }{\rm{]}}\)
2, 3, 7, 8 – TCDD (dioxin) là chất độc mạnh nhất trong các hoá chất, nó độc gấp 1 triệu lần tất cả các chất độc đã có trong tự nhiên và tồn tại lâu bền nhất. Một nghiên cứu năm 2002 của trường Đại học Columbia đã tính rằng chỉ 80 gam dioxin pha vào nước uống sẽ “giết sạch” người dân của 1 thành phố với 8 triệu dân. Dioxin phân huỷ vô cùng chậm trong đất, mất 8 năm để lượng dioxin giảm đi một nửa. Nếu một mảnh đất có chứa 0,132.10-3 gam dioxin thì phải mất bao nhiêu lâu để lượng dioxin đó còn lại là 4,125.10-6 gam?
Từ 0,132.10-3 gam dioxin phân huỷ còn lại 4,125.10-6 gam dioxin tức đã giảm \(\dfrac{{0,{{132.10}^{ - 3}}}}{{4,{{125.10}^{ - 6}}}} = {2^5}\)lần
=> Thời gian cần thiết để 0,132.10-3 gam phân huỷ còn 4,125.10-6 gam dioxin là 8.5 = 40 năm
Hình dưới đây minh hoạ ảnh hưởng của yếu tố nào đến tốc độ phản ứng?

Hình trên minh hoạ ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng
Cho bảng số liệu biểu diễn sự phụ thuộc thời gian phản ứng vào nồng độ chất tham gia phản ứng:

Phát biểu nào sau đây không đúng?
Khi tăng nồng độ thì tốc độ phản ứng tăng => Thời gian phản ứng giảm
=> Chiều sắp xếp theo chiều giảm dần thời gian phản ứng là t1 > t2 > t3 > t4
Hình dưới đây biểu diễn thể tích của khí carbonic sinh ra theo thời gian khi cho calcium carbonate phản ứng với dung dịch hydrochloric acid:

Tốc độ của phản ứng xảy ra nhanh nhất vào thời điểm.
Từ đồ thị ở thời điểm t1 đường biểu diễn thể tích của khí carbonic theo thời gian có độ dốc lớn nhất => Tốc độ phản ứng xảy ra nhanh nhất
Cho hai miếng magnesium có kích thước giống nhau. Một miếng là khối magnesium đặc (A), một miếng có nhiều lỗ nhỏ bên trong và trên bề mặt (B). Thả hai miếng magnesium vào hai cốc đựng dung dịch H2SO4 1M có cùng thể tích. Theo dõi thể tích khí thoát ra theo thời gian, kết quả thu được được biểu diễn ở hình dưới đây:
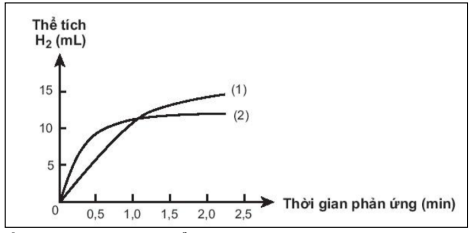
Phát biểu nào sau đây không đúng?
- Vì thanh B có nhiều lỗ nhỏ => Thanh B có tổng diện tích tiếp xúc bề mặt lớn hơn thanh A => Ban đầu tốc độ phản ứng ở thanh B nhanh hơn => Tốc độ thoát khí nhanh hơn.
- Do hai miếng có cùng kích thước, mà thanh B có nhiều lỗ nhỏ => Khối lượng magnesium ở thanh B nhỏ hơn thanh A nên sau một thời gian phản ứng thì lượng magnesium ở thanh B hết => Lượng khí thoát ra không đổi và nhỏ hơn lượng khí thoát ra ở thanh A
=> D sai
Cho phương trình hóa học: A(k) + 2B(k) → AB2 (k)
Tốc độ phản ứng sẽ tăng nếu
Tốc độ phản ứng sẽ tăng nếu
- tăng áp suất
- tăng nhiệt độ
- tăng nồng độ khí A, B
Cho phản ứng hóa học sau : 2H2O2 (l) $\xrightarrow{{Mn{O_2}}}$ 2H2O(l) + O2 (k). Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng trên ?
Các yếu tố ảnh hưởng đến tốc độ của phản ứng trên :
- Nồng độ H2O2 : nếu tăng nồng độ H2O2 thì tốc độ phản ứng tăng.
- Thêm chất xúc tác : làm tăng tốc độ của phản ứng.
- Nhiệt độ : nếu tăng nhiệt độ thì tốc độ phản ứng tăng.
→ Yếu tố không ảnh hưởng đến tốc độ của phản ứng là áp suất vì chất tham gia không phải là chất khí.
Cho phản ứng: 2SO2 + O2 $\overset {} \leftrightarrows $ 2SO3. Biết thể tích bình phản ứng không đổi. Tốc độ phản ứng tăng lên 4 lần khi
Gọi k là hằng số tốc độ phản ứng => Công thức tính tốc độ phản ứng theo k: v = k[SO2]2[O2]
- Khi tăng nồng độ của SO2 lên 2 lần thì tốc độ phản ứng tăng lên 22 = 4 lần
- Khi tăng nồng độ của SO2 lên 4 lần thì tốc độ phản ứng tăng lên 42 = 16 lần
- Khi tăng nồng độ của O2 lên 2 lần thì tốc độ phản ứng tăng lên 2 lần
- Khi tăng đồng thời nồng độ SO2 và O2 lên 2 lần thì tốc độ phản ứng tăng lên 22.2 = 8 lần
Tốc độ của phản ứng: H2 + I2 $\overset{{}}{\leftrightarrows}$ 2HI tăng lên bao nhiêu lần khi tăng nhiệt độ của phản ứng tăng từ ${{20}^{o}}C$ lên ${{170}^{o}}C$? Biết rằng khi tăng nhiệt độ thêm ${{25}^{o}}C$ thì tốc độ phản ứng tăng lên 3 lần.
Tốc độ phản ứng tăng lên 3 lần nên $\dfrac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3$ mà ${v_{{t_2}}} = \,\,{v_{{t_1}}}.{k^{\dfrac{{{t_2} - {t_1}}}{{10}}}}\,\, \to \,\,{k^{\dfrac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,\dfrac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = \,\,3\,\,\,\,(1)$
- Tăng nhiệt độ thêm ${25^o}C$ thì t2 – t1 = ${25^o}C$
Thay vào (1) : ${k^{\dfrac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,{k^{2,5}} = 3\,\, \to \,\,k\,\,\, = \,1,552$
- Khi phản ứng tăng từ ${20^o}C\,$ lên ${170^o}C\,$ thì t2 – t1 = ${150^o}C\,$
→ $\,\,\dfrac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}}\,\, = {k^{\dfrac{{{t_2} - {t_1}}}{{10}}}}\, = \,\,1,{552^{15}} = \,\,730$
=> Tốc độ phản ứng tăng lên 730 lần.
Tốc độ phản ứng phụ thuộc vào các yếu tố sau:
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, nhiệt độ, áp suất, chất xúc tác và bề mặt tiếp xúc.
Một phản ứng đơn giản xảy ra trong bình kín: 2NO (k) + O2 (k) \( \rightleftarrows \) 2NO2 (k). Giữ nguyên nhiệt độ, nén hỗn hợp phản ứng xuống còn 1/3 thể tích. Kết luận nào sau đây không đúng ?
Thể tích giảm dẫn đến áp suất tăng → cân bằng sẽ chuyển dịch theo chiều chống lại sự tăng áp suất → cân bằng chuyển dịch theo chiều thuận (chiều thuận giảm số phân tử khí)→ C đúng
Giả sử ban đầu khi ở trạng thái cân bằng: [NO] = a(M); [O2] = b (M); [NO2] = c (M)
→ Tốc độ chiều thuận: Vt = k[NO]2.[O2] = k.a2.b
→ Tốc độ chiều nghịch: Vn = k’[NO2]2 = k’c
Khi giảm thể tích xuống 3 lần thì nồng độ các chất tăng lên 3 lần
Vthuận sau = k[3NO]2.[3O2] = 32.3 k[NO]2.[O2] = 27 k.a2.b = 27Vt → Tốc độ phản ứng thuận tăng 27 lần → A đúng
Vnghịch sau = k’[3NO2]2 = 32 k’[NO2]2 = 9 k’c = 9Vn → Tốc độ phản ứng nghịch tăng 9 lần → B đúng
Có hai cốc chứa dung dịch Na2SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí nghiệm trên là
Cốc A có nồng độ lớn hơn cốc B, nên khi cho cùng nồng độ dd H2SO4 vào 2 cốc thì cốc A sẽ có tốc độ phản ứng nhanh hơn cốc B.
→ cốc A xuất hiện kết tủa nhanh hơn cốc B.

