Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Sách kết nối tri thức với cuộc sống
Một hợp chất A tạo thành từ các ion X+ và Y2-. Trong ion X+ có 5 hạt nhân của hai nguyên tố và có 10 eletron. Trong ion Y2- có 4 hạt nhân thuộc hai nguyên tố trong cùng một chu kì và đứng cách nhau một ô trong bảng tuần hoàn. Tổng số electron trong Y2- là 32. Công thức hoá học của A là
* Xác định X+:
X+ có 10 electron => Tổng proton trong 5 hạt nhân là 11 => Số proton trung bình là \(\dfrac{{11}}{5} = 2,2\)
=> X+ có 1 nguyên tử H. Gọi nguyên tử thứ hai trong X+ là R
- TH1: \(R{H_4}^ + :{Z_R} + 4 = 11 \Rightarrow {Z_R} = 7 \Rightarrow \)R là N => X+ là NH4+ (thoả mãn)
- TH2: \({R_2}{H_3}^ + :2{Z_R} + 3 = 11 \Rightarrow {Z_R} = 4\) (loại)
- TH3: \({R_3}{H_2}^ + :3{Z_R} + 2 = 11 \Rightarrow {Z_R} = 3\) (loại)
* Xác định Y2-:
Y2- có 32 electron => Tổng số proton trong 4 nguyên tử là 30 => Số proton trung bình là \(\dfrac{{30}}{4} = 7,5\) => 2 nguyên tử trong Y2- đều thuộc cùng chu kì 2. Gọi 2 nguyên tử trong Y2- là A, B. Mà hai nguyên tố trong Y2- đứng cách nhau một ô trong bảng tuần hoàn => \({Z_B} = {Z_A} + 2\)
- TH1: \(A{B_3}^{2 - }:{Z_A} + 3{Z_B} = 30 \Rightarrow {Z_A} = 6;{Z_B} = 8\)=> CO32-
- TH2: \({A_2}{B_2}^{2 - }:2{Z_A} + 2{Z_B} = 30 \Rightarrow {Z_A} = 6,5;{Z_B} = 8,5\) (loại)
- TH3: \({A_3}{B^{2 - }}:3{Z_A} + {Z_B} = 30 \Rightarrow {Z_A} = 7;{Z_B} = 9\) (loại)
Vậy A có công thức hoá học là (NH4)2CO3
Nguyên tố X có electron phân lớp ngoài cùng là np2, nguyên tố Y có electron phân lớp ngoài cùng là np3. Hợp chất khí với hydrogen của X chứa a% khối lượng X, oxide ứng với hoá trị cao nhất của Y chứa b% khối lượng Y. Tỉ số a:b = 3,365. Hợp chất A tạo bởi X và Y có nhiều ứng dụng chỉnh hình trong lĩnh vực y khoa, vật liệu này cũng là một sự thay thế cho PEEK (polyether ether ketone) và titan, được sử dụng cho cac thiết bị tổng hợp tuỷ sống. Khối lượng mol của A là 140 g/mol. Phát biểu nào sau đây đúng?
Theo đề bài có:
- Nguyên tố X có electron phân lớp ngoài cùng là np2 => Lớp electron ngoài cùng của X là ns2np2 => X thuộc nhóm IVA trong bảng tuần hoàn
- Nguyên tố Y có electron phân lớp ngoài cùng là np3 => Lớp electron ngoài cùng của Y là ns2sp3 => Y thuộc nhóm VA trong bảng tuần hoàn
=> Hợp chất khí với hydrogen của X là XH4, oxide ứng với hoá trị cao nhất của Y là Y2O5
\( \Rightarrow \dfrac{X}{{X + 4}}:\dfrac{{2Y}}{{2Y + 80}} = 3,365\) (1)
Hợp chất tạo bởi X và Y có dạng là X3Y4 => 3X + 4Y = 140 (2)
Từ (1) và (2) => \(X \simeq 28\) và \(Y \simeq 14\) => X là Si; Y là N => Hợp chất A là Si3N4
A sai.
B sai
C đúng
D sai. Oxide ứng với hoá trị cao nhất của Y là N2O5.
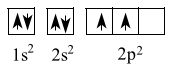
Cho hình vẽ biểu diễn kích thước của các nguyên tử Na, K, F, Cl dưới đây:

Biết số thứ tự của Na, K, F, Cl trong bảng tuần hoàn hoá học lần lượt là 11, 19, 9, 17. Phát biểu nào sau đây đúng?
Cấu hình nguyên tử của
- Na (Z=11): 1s22s22p63s1 => Nhóm IA, chu kì 3
- K (Z=19): 1s22s22p63s23p64s1 => Nhóm IA, chu kì 4
- F (Z=9): 1s22s22p5 => Nhóm VIIA, chu kì 2
- Cl (Z=17): 1s22s22p63s23p5 => Nhóm VIIA, chu kì 3
- Trong cùng 1 nhóm A theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử tăng dần
=> \({r_{Na}} < {r_K}\) và \({r_F} < {r_{Cl}}\) (1)
- Trong cùng 1 chu kì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần
=> \({r_{Cl}} < {r_{Na}}\)(2)
Từ (1) và (2) => \({r_F} < {r_{Cl}} < {r_{Na}} < {r_K}\)
=> X là F, Y là Cl, Z là Na và T là K
Cho bảng tuần hoàn mô phỏng dưới đây:

Cho các phát biểu sau:
(a) A và D đều có 3 lớp electron.
(b) B, C đều tạo với oxygen hợp chất có dạng X2O.
(c) A có 4 electron lớp ngoài cùng và có 2 lớp electron.
(d) E có 4 electron lớp ngoài cùng và có ba lớp electron.
(e) D và E đều tạo với hydrogen hợp chất có dạng RH.
Số phát biểu đúng là
(a) sai. A nằm ở chu kì 3 có 3 lớp electron. D nằm ở chu kì 2 có 2 lớp electron
(b) đúng vì B và C đều thuộc nhóm IA
(c) sai. A thuộc chu kì 3, nhóm IVA => A có 3 lớp electron và có 4 electron lớp ngoài cùng
(d) sai. A có 3 lớp electron và có 4 electron lớp ngoài cùng
(e) sai. E có 3 lớp electron và 7 electron lớp ngoài cùng
Cho các nguyên tử X, Y, Z, T thuộc nhóm IA có bán kính trung bình như hình vẽ dưới đây:

Chiều sắp xếp tăng dần tính kim loại là
Trong một nhóm A theo chiều tăng dần điện tích hạt nhân, tính kim loại và bán kính nguyên tử tăng dần
=> Vị trí của các nguyên tử X, Y, Z, T trong nhóm IA theo chiều tăng dần điện tích hạt nhân là T, Z, Y, Z
=> Chiều tăng dần về tính kim loại là T, Z, Y, X
Cho biết độ âm điện của các nguyên tử từ X đến T thuộc chu kì 2 và 3 của bảng tuần hoàn các nguyên tố hoá học trong hình dưới đây:

X và Y là các nguyên tố thuộc nhóm IVA, Z và T là các nguyên tố thuộc nhóm VIIA. Phát biểu nào sau đây đúng?
Theo bài có:
- X và Y đều thuộc nhóm IVA, từ hình minh hoạ có độ âm điện của X nhỏ hơn của Y => X thuộc chu kì 3, Y thuộc chu kì 2
- Z và T đều thuộc nhóm VIIA, từ hình minh hoạ có độ âm điện của Z nhỏ hơn của T => Z thuộc chu kì 3, T thuộc chu kì 2
A đúng
B sai. Y thuộc nhóm IVA => Y tạo được hidroxit ứng với oxit cao nhất là H2YO3
C sai. Z thuộc chu kì 3, T thuộc chu kì 2 => Bán kính nguyên tử của Z lớn hơn T
D sai
Mô hình dưới dây biểu diễn sự sắp xếp electron của nguyên tử nguyên tố X đến nguyên tố T ở trạng thái cơ bản

Cho các phát biểu sau:
(a) Cả 4 nguyên tố đều thuộc cùng một chu kì trong bảng tuần hoàn.
(b) Nguyên tử của nguyên tố Y có 5 orbital chứa electron.
(c) Nguyên tố Y có bán kính nguyên tử nhỏ hơn nguyên tố T.
(d) Bán kính anion T- lớn hơn cation X+.
Số phát biểu đúng là
(a) đúng vì cả 4 nguyên tố đều có cùng số lớp electron
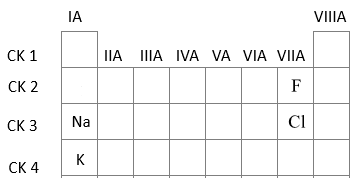
(b) sai. Cấu hình electron nguyên tử của Y là 1s22s22p2
Biểu diễn bằng cấu hình orbital nguyên tử:
=> Nguyên tố Y có 4 orbital nguyên tử chứa electron
(c) sai
Có 4 nguyên tố trên đều cùng thuộc một chu kì. Thứ tự sắp xếp theo chiều tăng dần số đơn vị điện tích hạt nhân là Y, Z, X, T
Trong một chu kì theo chiều tăng dần số đơn vị điện tích hạt nhân, bán kính nguyên tử giảm dần
=> Thứ tự giảm dần về bán kính nguyên tử là Y>Z>X>T
=> Y có bán kính nguyên tử lớn hơn T
(d) đúng
Có các bán phản ứng sau:
\(X \to {X^ + } + 1e\) => Để tạo thành X+ thì X mất đi 1 electron => X+ có 2 lớp electron
\(T + 1e \to {T^ - }\) => Để tạo thành T- thì T thêm 1 electron => T- có 3 lớp electron
=> T- có bán kính nguyên tử lớn hơn X+
=> Số phát biểu đúng là 2
Cấu hình electron của ion X3+ là 1s22s22p63s23p63d5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
X3+: 1s22s22p63s23p63d5
Vì nguyên tử X mất 3e tạo thành ion X3+
=> Cấu hình X: 1s22s22p63s23p63d64s2
$ \to $ X thuộc chu kì 4, nhóm VIIIB
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Y có mức năng lượng 3p và có 1 electron lớp ngoài cùng
=> Cấu hình electron Y: 4s1
=> Cấu hình của Y là [Ar]4s1
=> ZY = 19.
=> có 1 electron ở lớp ngoài cùng => Y là kim loại.
Nguyên tử X và Y có số electron hơn kém nhau là 2 và mức năng lượng cao nhất của X là 3p. => ZX = 19-2 =17
=> Cấu hình của X là [Ne]3s23p5
=> có 7 electron ở lớp ngoài cùng => X là phi kim.
Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
M (Z = 11) $ \to $ M là Na: 1s22s22p63s1 → Na thuộc chu kì 3, nhóm IA
X (Z = 17) $ \to $ X là Cl: 1s22s22p63s23p5 → Cl thuộc chu kì 3, nhóm VIIA
Y (Z = 9) $ \to $ Y là F: 1s22s22p5 → F thuộc chu kì 2, nhóm VIIA
R (Z = 19) $ \to $ Z là K: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA
Vị trí các nguyên tố trong bảng tuần hoàn theo sơ đồ sau:
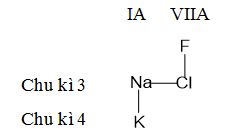
Độ âm điện tăng thì tính phi kim tăng mà đi từ trái qua phải, từ dưới lên tính phi kim tăng
=> Độ âm điện theo thứ tự tăng dần: K < Na < Cl < F
Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
K: [Ar]4s1 → chu kì 4, nhóm IA
N: 1s22s22p3 → chu kì 2, nhóm VA
Si: [Ne]3s23p2 → chu kì 3, nhóm IVA
Mg: [Ne]3s2 → chu kì 3, nhóm IIA
Vị trí các nguyên tố trong bảng tuần hoàn theo sơ đồ sau:
Chu kì càng lớn bán kính càng lớn:
=> K bán kính lớn nhất, N có bán kính bé nhất
Trong cùng một chu kì theo chiều trái qua phải bán kính giảm dần
=> Si bán kính bé hơn Mg
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp
TH1. pY – pX = 1 (X, Y thuộc chu kì 2, 3)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 17 \hfill \\{p_X} = 16 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^5} \hfill \\X:\,{\text{[}}Ne]3{s^2}3{p^4} \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,\,Cl \hfill \\X:\,\,S \hfill \\ \end{gathered} \right.$
A sai vì đơn chất X là chất rắn ở điều kiện thường
B sai vì trong 1 chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện tăng dần
$ \to $ Độ âm điện của Y lớn hơn độ âm điện của X
C sai vì lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 7 electron
TH2. pY – pX = 11 (X, Y thuộc chu kì 4, 5, 6, 7)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 22 \hfill \\{p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^6}3{d^2}4{s^2} \hfill \\X:\,{\text{[}}Ne]3{s^1} \hfill \\ \end{gathered} \right.$
$ \to $Loại vì X, Y không thuộc cùng một chu kì
Cho cấu hình electron của nguyên tử X: 1s22s22p5. X là nguyên tố nào và có tính chất gì?
X là nguyên tố p vì electron cuối cùng được điền vào phân lớp p
X thuộc nhóm A có 7 electron lớp ngoài cùng nên X là phi kim
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Từ vị trí của nguyên tố trong bảng tuần hoàn, không thể
Đáp án D
Có 3 nguyên tố X, Y, Z thuộc nhóm A trong bảng tuần hoàn:
- X, Y cùng chu kì và ở hai nhóm liên tiếp
- X, Z ở hai chu kì liên tiếp và cùng nhóm
- Các hydroxide của Y, X, Z có tính base tăng dần theo thứ tự
- Cấu hình electron của X là …3s2
Phát biểu nào sau đây không đúng?
- Cấu hình electron đầy đủ của X là 1s22s22p63s2
⇒ Vị trí của X: ô số 12, chu kì 3, nhóm IIA (A đúng)
- X, Y cùng chu kì và ở hai nhóm liên tiếp
⇒ Y chu kì 3, nhóm IA hoặc IIIA
- X, Z ở hai chu kì liên tiếp và cùng nhóm
⇒ Z chu kì 2 hoặc 4, nhóm IIA

- Các hydroxide của Y, X, Z có tính base tăng dần theo thứ tự
⇒ Y nhóm IIIA, chu kì 3; Z nhóm IIA, chu kì 4
⇒ Oxide cao nhất của Y là Y2O3 (B sai)
Y là nhôm và Al(OH)3 là chất lượng tính (C đúng)
Z là Ca tác dụng được với nước ở nhiệt độ thường tạo base tương ứng và khí H2 (D đúng)
Hòa tan 60,9 gam hỗn hợp hai muối bari của hai halogen (ở hai chu kì liên tiếp) vào nước rồi cho tác dụng vừa đủ với dung dịch K2SO4. Sau khi phản ứng hoàn toàn thu được 58,25 gam kết tủa và dung dịch muối. Cô cạn dung dịch thu được hỗn hợp hai muối khan. Phát biểu nào sau đây không đúng?
\(\begin{array}{*{20}{c}}{Ba{X_2}}\\a\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{{K_2}S{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{2KX}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{BaS{O_4}}\\a\end{array}\)
\(\begin{array}{*{20}{c}}{Ba{Y_2}}\\b\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{{K_2}S{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{2KY}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{BaS{O_4}}\\b\end{array}\)
\({n_{BaS{O_4}}} = a + b = \dfrac{{58,25}}{{233}} = 0,25(1)\)
60,9=(137+2X)a+(137+2Y)b ⇒ 2Xa+2Yb=60,9-137(a+b)=26,65 ⇒ Xa+Yb=13,325 (2)
m muối = (39+X).2a+(39+Y).2a=78.(a+b)+2Xa+2Yb=19,5+26,65=46,15 (g) (A đúng)
Nhân hai vế của (1) với X ta được: Xa+Xb=0,25X (1’)
Từ (1’) và (2) ⇒ b(Y-X)=13,325-0,25X
⇒ \(b = \dfrac{{13,325 - 0,25X}}{{Y - X}}\)
Có 0<b<a+b=0,25 ⇒ \(0 < \dfrac{{13,325 - 0,25X}}{{Y - X}} < 0,25\)
Giả sử Y ở chu kì lớn hơn ⇒ Y-X>0 ⇒ X<53,3<Y
Do Y, X ở 2 chu kì liên tiếp của cùng phân nhóm ⇒ X là Cl, Y là Br (B đúng)
⇒ b=0,1 mol ⇒ a= 0,15 mol
⇒ \(\% {m_{Ba{Y_2}}} = \dfrac{{0,1.297}}{{60,9}}.100\% \approx 48,77\% \) (C đúng)
D sai vì halogen có khối lượng nhỏ hơn là Cl không phải Flo (Flo mới có giá trị độ âm điện lớn nhất trong các nguyên tố của bảng tuần hoàn)
X và Y là hai nguyên tố nhóm A cùng một chu kì và thuộc hai nhóm liên tiếp có tổng số proton là 13 biết ZX<ZY. Cho các phát biểu sau:
(1) Oxide cao nhất của X tan trong nước tạo dung dịch acid yếu.
(2) Y có 3 electron độc thân.
(3) Thứ tự tính phi kim tăng dần là X, Y.
(4) Y có độ âm điện lớn hơn X.
(5) Tính acid của hydroxide của X yếu hơn của Y.
Số phát biểu đúng là
Có ZX+ZY=13 (1)
X và Y là hai nguyên tố nhóm A cùng một chu kì, thuộc hai nhóm liên tiếp và ZX<ZY ⇒ ZY=ZX+1 (2)
Từ (1) và (2) ⇒ ZX=6; ZY=7
Cấu hình electron của X: 1s22s22p2
⇒ Vị trí của X: ô số 6, chu kì 2, nhóm IVA (X là C)
⇒ Oxide cao nhất của X là CO2 tan trong nước tạo acid yếu H2CO3 ((1) đúng)
Cấu hình electron của Y: 1s22s22p3 ((2) đúng)

X và Y cùng chu kì 2.
- Trong một chu kì, theo chiều điện tích hạt nhân tăng dần, tính phi kim tăng dần nên X có tính phi kim yếu hơn Y ((3) đúng)
- Trong một chu kì, theo chiều điện tích hạt nhân tăng dần, độ âm điện tăng dần nên X có độ âm điện nhỏ hơn Y ((4) đúng)
- Trong một chu kì, theo chiều điện tích hạt nhân tăng dần, tính acid của hydroxide tăng dần nên hydroxide của Y có tính acid mạnh hơn hydroxide của X ((5) đúng)

