Cấu hình electron phân lớp ngoài cùng của các nguyên tử R, X, Y lần lượt là 2p4, 3s1, 3p1. Phân tử hợp chất ion đơn giản giữa X và R, giữa Y và R lần lượt có số hạt mang điện là :
- Xác định R, X, Y
+ Cấu hình electron phân lớp ngoài cùng của các nguyên tử R là 2p4
=> Cấu hình e của R : 1s22s22p4 => R là Oxi
+ Cấu hình electron phân lớp ngoài cùng của các nguyên tử X là 3s1
=> Cấu hình e của X: 1s22s22p63s1 => X là Na
+ Cấu hình electron phân lớp ngoài cùng của các nguyên tử Y là 3p1
=> Cấu hình e của Y: 1s22s22p63s23p1 => Y là Al
- Xác định hợp chất và số hạt mang điện
+ Hợp chất ion đơn giản giữa X và R là: Na2O
=> tổng số hạt mang điện của Na2O là: (11 + 11).2 + 8 + 8 = 60
+ Hợp chất ion đơn giản giữa Y và R là: Al2O3
=> Tổng số hạt mang điện của Al2O3 là: (13 + 13).2 + (8 + 8).3 = 100
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
Liên kết cộng hóa trị không cực thông thường là liên kết giữa các nguyên tử của cùng một nguyên tố.
=> Các chất mà phân tử chỉ chứa liên kết cộng hóa trị không cực là N2, H2
Hợp chất trong phân tử có liên kết ion là:
Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
A đúng vì:
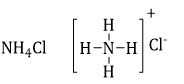
Phân tử NH4Cl chứa liên kết ion tạo thành do lực hút tĩnh điện giữa $NH_4^ + $ và $C{l^ - }$.
B, C, D sai vì liên kết trong phân tử NH3, HCl, H2O là liên kết cộng hóa trị.
Các chất mà phân tử không phân cực là:
A sai vì HBr là phân tử có cực.
C sai vì NH3 là phân tử có cực.
D sai vì HCl là phân tử có cực.
B đúng vì $Cl - Cl\,\,\,;\,\,\,O = C = O\,\,\,;\,\,\,CH \equiv CH$ là phân tử không phân cực.
Chú ý: liên kết C = O, C – H là liên kết cộng hóa trị phân cực.
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là:
A sai vì liên kết O=O trong O2 là liên kết cộng hóa trị không phân cực
B đúng vì liên kết H với O, H với F, H với S là liên kết cộng hóa trị phân cực
C sai vì liên kết O-O trong O3 là liên kết cộng hóa trị không phân cực
D sai vì liên kết Cl-Cl trong Cl2 là liên kết cộng hóa trị không phân cực
Cho biết tổng số electron trong anion AB32- là 42. Trong các hạt nhân A cũng như B có số proton bằng với số neutron. Khi đốt hỗn hợp A, B thu được một hợp chất C. Cho biết C thuộc loại liên kết gì?
Tổng số electron trong anion AB32- là 42 => eA + 3.eB + 2 = 42 => pA + 3.pB = 40
Trong hạt nhân A cũng như B có số proton bằng số neutron => nA = pA ; nB = pB
=> pA = 16 (S) và pB = 8 (O) vì hạt nhân S và O có số p = số n
=> hợp chất C là SO2
Hiệu độ âm điện = 3,44 – 2,58 = 0,86
=> Liên kết trong C là liên kết cộng hóa trị có cực
Nguyên tử nguyên tố T có tổng số hạt cơ bản là 24 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8 hạt. Trong ion G4+ tổng số hạt cơ bản là 14 hạt, số hạt mang điện nhiều hơn số hạt không mang điện là 2 hạt. Liên kết hoá học trong phân tử giữa T và G là:
Trong nguyên tử X:
- Tổng số hạt: 2ZX + NX = 24
- Số hạt mang điện nhiểu hơn số hạt không mang điện: 2ZX – NX = 8
=> ZX = 8 (O)
Trong ion G4+:
- Tổng số hạt: (2ZY – 4) + NY = 14
- Số hạt không mang điện nhiều hơn số hạt mang điện: (2ZY – 4) - NY = 2
=> ZY = 6 (C)
=> Liên kết giữa C và O là liên kết CHT có cực
Muối X được tạo thành bởi một kim loại hóa trị II và phi kim hóa trị I. Hòa tan 4,44 gam X vào H2O rồi chia làm hai phần bằng nhau
- Cho phần một tác dụng với dung dịch AgNO3 dư thu được 5,74 gam kết tủa.
- Cho phần hai tác dụng với dung dịch Na2CO3 dư thu được 2 gam kết tủa.
Liên kết trong X là liên kết
Đặt kim loại A, phi kim B ⇒ Muối X là AB2
Khối lượng AB2 trong mỗi phần là 4,44:2=2,22 g
AB2 + 2AgNO3 → 2AgB + A(NO3)2
\({n_{A{B_2}}} = \dfrac{1}{2}.{n_{AgB}} \Rightarrow \dfrac{{2,22}}{{A + 2B}} = \dfrac{1}{2}.\dfrac{{5,74}}{{108 + B}}(1)\)
AB2 + Na2CO3 → ACO3+2NaB
\({n_{A{B_2}}} = {n_{AC{O_3}}} \Rightarrow \dfrac{{2,22}}{{A + 2B}} = \dfrac{2}{{A + 60}}(2)\)
Từ (1) và (2) ⇒ A=40 (Ca); B=35,5 (Cl)
Ca là một kim loại điển hình, Cl là một phi kim điển hình nên liên kết của X là liên kết ion
Nguyên tử X có 20 proton và nguyên tử Y có 17 electron. Công thức phân tử và bản chất liên kết của hợp chất hình thành giữa X và Y có thể là
- Cấu hình e của X: 1s22s22p63s23p64s2
=> X có xu hướng nhường 2e để đạt cấu hình bền của khí hiếm => X hóa trị 2+ => X là kim loại.
- Cấu hình e của Y: 1s22s22p63s23p5
=> Y có xu hướng nhận thêm 1e để đạt cấu hình bền của khí hiếm => X hóa trị 1- => X là phi kim.
Vậy công thức phân tử là XY2 và liên kết ion (vì là liên kết giữa kim loại điển hình nhóm IIA và phi kim điển hình nhóm VIIA).
Cho các nhận định sau:
(1) Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) Các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước.
(3) Hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là điện hóa trị của nguyên tố đó.
(4) Liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) Khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Số nhận định đúng là
(1) đúng vì liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(2) đúng vì các hợp chất cộng hóa trị phân cực thường tan nhiều trong nước (dung môi phân cực).
(3) sai vì hóa trị của các nguyên tố trong hợp chất cộng hóa trị được gọi là cộng hóa trị của nguyên tố đó.
(4) đúng vì hiệu độ âm điện của 2 nguyên tử giống nhau bằng 0 nên liên kết trong phân tử H2, N2, F2 thuộc loại liên kết cộng hóa trị không phân cực.
(5) đúng vì khi hình thành liên kết cộng hóa trị, các nguyên tử có thể góp chung 1, 2 hoặc 3 electron để hình thành 1,2 hoặc 3 cặp electron dùng chung.
Vậy có 4 phát biểu đúng.

