Bài 6: Xu hướng biến đổi một số tính chất hóa học của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Sách kết nối tri thức với cuộc sống
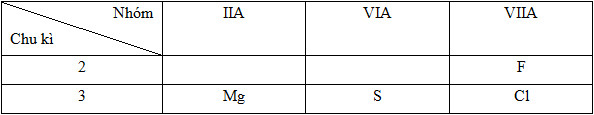
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
Dãy sắp xếp các nguyên tử theo chiều tăng dần bán kính nguyên tử là
Nhận thấy các nguyên tố cùng thuộc chu kì 2, riêng Na thuộc chu kì 3 => bán kính nguyên tử của Na lớn nhất
F là phi kim mạnh nhất => có độ âm điện lớn nhất => bán kính nguyên tử nhỏ nhất
O là phi kim => có độ âm điện lớn hơn Li => bán kính của O nhỏ hơn Li
=> Dãy sắp xếp các nguyên tử theo chiều tăng dần bán kính nguyên tử là : F, O, Li, Na.
Bán kính nguyên tử phụ thuộc vào
Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
Phát biểu nào sau đây không đúng?
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần.
Đáp án C
Cho các nguyên tố X, Y, Z, T có số hiệu nguyên tử lần lượt là 13, 6, 8, 9. Phát biểu nào sau đây không đúng khi nói về các nguyên tố trên?
13X: 1s22s22p63s23p1: Ô 13, chu kì 3, nhóm IIIA
6Y: 1s22s22p2: Ô 6, chu kì 2, nhóm IVA
8Z: 1s22s22p4: Ô 8, chu kì 2, nhóm VIA
9T: 1s22s22p5: Ô 9, chu kì 2, nhóm VIIA

A đúng vì T là Fluor (F) là nguyên tố có giá trị độ âm điện lớn nhất trong bảng tuần hoàn ⇒ D sai
B đúng
- Trong một chu kì theo chiều điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần ⇒ Thứ tự tăng dần của bán kính nguyên tử là T<Z<Y
- Trong một nhóm theo chiều điện tích hạt nhân tăng dần, bán kính nguyên tử tăng dần ⇒ Thứ tự tăng dần của bán kính nguyên tử là Y<X
⇒ Thứ tự tăng dần của bán kính nguyên tử là T<Z<Y<X
C đúng
- Trong một chu kì theo chiều điện tích hạt nhân tăng dần, tính kim loại giảm dần ⇒ Thứ tự tăng dần của tính kim loại là T<Z<Y
- Trong một nhóm theo chiều điện tích hạt nhân tăng dần, tính kim loại tăng dần ⇒ Thứ tự tăng dần của bán kính nguyên tử là Y<X
⇒ Thứ tự tăng dần của tính kim loại là T<Z<Y<X
X+, Y2+ có cùng cấu hình electron của nguyên tử argon (Z=18) và T có số hiệu nguyên tử là 12. Phát biểu nào sau đây đúng khi nói về X, Y, T?
Cấu hình electron của Ar: 1s22s22p63s23p6
Cấu hình electron của X: 1s22s22p63s23p64s1 (X+ + 1e thành X): ô 19, chu kì 4, nhóm IA
Cấu hình electron của Y: 1s22s22p63s23p64s2 (Y2+ + 2e thành Y): ô 20, chu kì 4, nhóm IIA
Cấu hình electron của T: 1s22s22p63s2: ô 12, chu kì 3, nhóm IIA
⇒ A sai

- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là X>Y
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử tăng dần ⇒ Thứ tự giảm dần về bán kính nguyên tử là Y>T
⇒ Chiều giảm dần bán kính nguyên tử là X>Y>T (B sai)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần ⇒ Thứ tự giảm dần về tính kim loại là X>Y
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần ⇒ Thứ tự giảm dần về tính kim loại là Y>T
⇒ Chiều giảm dần tính kim loại là X>Y>T (C đúng)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, độ âm điện tăng dần ⇒ Thứ tự giảm dần về độ âm điện là Y>X
- Trong một nhóm theo chiều tăng dần điện tích hạt nhân, độ âm điện giảm dần ⇒ Thứ tự giảm dần về độ âm điện là T>Y
=> Thứ tự giảm dần độ âm điện là T>Y>X (D sai)
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần.
Đáp án B
Tính chất của một nguyên tố mà nguyên tử dễ nhường electron để trở thành ion dương là
Tính chất của một nguyên tố mà nguyên tử dễ nhường electron để trở thành ion dương là tính kim loại
Đáp án A
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại và tính phi kim biến đổi như thế nào?
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần
Đáp án B
T, Q là hai nguyên tố thuộc cùng nhóm và ở hai chu kì liên tiếp. Tổng số điện tích hạt nhân của T và Q là 58. Phát biểu nào sau đây không đúng?
Theo đề bài:
ZT +ZQ = 58 (1)
- Nếu T, Q hơn nhau 8 nguyên tố, ta có:
ZQ = ZT +8 (2)
(1) và (2) ⇒ ZT= 25, ZQ = 33.
Cấu hình electron của T: 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (chu kì 4, nhóm VIIB)
Cấu hình electron của Q: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 (chu kì 4, nhóm VA) (trái với giả thiết).
– Nếu T, Q hơn nhau 18 nguyên tố, ta có:
ZQ = ZT +18 (2’)
(1) và (2’) ⇒ ZT = 20, ZQ = 38.
Cấu hình electron của T: 1s2 2s2 2p6 3s2 3p64s2 (chu kì 4, nhóm IIA)
Cấu hình electron của Q: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 (chu kì 5, nhóm IIA)
T, Q phù hợp.
- Nếu ZQ =ZT +32. Lí luận tương tự và kết luận không phù hợp
Nhận thấy T, Q cùng thuộc nhóm IIA nhưng khác chu kì
Trong một nhóm A theo chiều điện tích hạt nhân tăng dần tính kim loại tăng dần ⇒ T có tính kim loại nhỏ hơn Q

