Số oxi hóa của iron trong chất nào là lớn nhất?
Số oxi hóa của O trong các hợp chất thường là -2
Số oxi hóa của hợp chất bằng không
Số oxi hóa của hợp chất bằng tổng số oxi hóa của các nguyên tố
Với Fe2O3: Gọi số oxi hóa của iron trong hợp chất là x
⇒ 2.x+3.(-2)=0 ⇒ x=+3
Làm tương tự với các hợp chất còn lại thì thấy +3 là số oxi hóa cao nhất của Fe
Cho phương trình hóa học: $3C{l_2} + 6KOH\xrightarrow{{{t^o}}}5KCl + KCl{O_3} + 3{H_2}O$. Chất Cl2 đóng vai trò
\(\mathop {C{l_2}}\limits^0 + 2e \to \mathop {2Cl}\limits^{ - 1} \): Cl2 nhận electron nên là chất oxi hóa
\(\mathop {C{l_2}}\limits^0 \to \mathop {2Cl}\limits^{ + 5} + 10e\): Cl2 nhường electron nên là chất khử
⇒ Cl2 trong phản ứng trên vừa là chất oxi hóa, vừa là chất khử
Cho phương trình của phản ứng sau:
\(F{e_x}{O_y} + {H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + S{O_2} + {H_2}O\)
Hệ số cân bằng của H2SO4 là
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\({\mathop {Fe}\limits^{ + 2y/x} _x}{O_y} + {H_2}\mathop S\limits^{ + 6} {O_4} \to {\mathop {Fe}\limits^{ + 3} _2}{(S{O_4})_3} + \mathop S\limits^{ + 4} {O_2} + {H_2}O\)
Do \(\mathop S\limits^{ + 6} \) trong H2SO4 xuống \(\mathop S\limits^{ + 4} \) trong SO2 nên H2SO4 là chất oxi hóa
⇒ FexOy là chất khử
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} }\\{\mathop {2xFe}\limits^{ + 2y/x} \to \mathop {2xFe}\limits^{ + 3} + (6x - 4y)e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
Bước 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2F{e_x}{O_y} + (6x - 2y){H_2}S{O_4} \to xF{e_2}{(S{O_4})_3} + (3x - 2y)S{O_2} + (6x - 2y){H_2}O\)
Đâu không phải đặc điểm của phản ứng oxi hóa – khử?
Chất khử là chất nhường electron
Cho phương trình hóa học : 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Kết luận nào sau đây là đúng?
$4\overset{+2}{{Fe}}\,{{\left( OH \right)}_{2}}+{{\overset{0}{{O}}\,}_{2}}+\text{ }2{{H}_{2}}O\text{ }\to \text{ }4\overset{+3}{{Fe}}\,{{(\overset{-2}{{O}}\,H)}_{3}}.$
Quá trình cho – nhận e:
$\overset{+2}{{Fe}}\,\,\,\to \text{ }\overset{+3}{{Fe}}\,\,\,+\,\,1\text{e}$ => Fe(OH)2 là chất khử
${{\overset{0}{{O}}\,}_{2}}+\text{ 4e }\to \text{ 2}\overset{-2}{{O}}\,$ => O2 là chất oxi hóa
Cho ba phản ứng hóa học dưới đây
1) 2Na + 2H2O → 2NaOH + H2↑
2) CO2 + Ca(OH)2 → CaCO3↓ + H2O
3) 2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
Các phản ứng oxi hóa khử là
Phản ứng oxi hóa – khử làm thay đổi số oxi hóa của các chất
=> có 2 phản ứng oxi hóa khử là
$\begin{align} & 1)~2\overset{0}{\mathop{Na}}\,~+~2{{\overset{+1}{\mathop{H}}\,}_{2}}{{O}_{{}}}\to \text{}2\overset{+1}{\mathop{Na}}\,OH~+{{\overset{0}{\mathop{~H}}\,}_{2}} \\ & 3)\text{ }2K\overset{+5}{\mathop{Cl}}\,{{\overset{-2}{\mathop{O}}\,}_{3}}~\to 2K\overset{1}{\mathop{Cl}}\,~+\text{ }3{{\overset{0}{\mathop{O}}\,}_{2}} \\ \end{align}$
Ở phản ứng nào sau đây, H2O không đóng vai trò chất oxi hoá hay chất khử?
H2O không đóng vai trò chất oxi hoá hay chất khử => H2O không thay đổi số oxi hóa
$A{{l}_{4}}{{C}_{3}}+\text{ }12{{\overset{+1}{\mathop{H}}\,}_{2}}\overset{-2}{\mathop{O}}\,\to 4Al{{(\overset{-2}{\mathop{O}}\,\overset{+1}{\mathop{H}}\,)}_{3}}+\text{ }3C{{\overset{+1}{\mathop{H}}\,}_{4}}$
Cho quá trình sau: $\overset{+\text{3}}{\mathop{\text{Fe}}}\,$ + 1e → $\overset{+\text{2}}{\mathop{\text{Fe}}}\,$. Trong các kết luận sau, kết luận nào là đúng?
Quá trình nhận electron gọi là quá trình khử (sự khử)
Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Sau khi cân bằng, hệ số của phân tử các chất là phương án nào sau đây?
${{\overset{+8/3}{\mathop{Fe}}\,}_{3}}{{O}_{4}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\to \text{}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{}+\text{ }{{H}_{2}}O$
$\begin{matrix} \text{3x} \\ {} \\ \text{1x} \\\end{matrix}\left| \begin{align} & 3\overset{+8/3}{\mathop{F\text{e}}}\,\,\,\to \,\,3\overset{+3}{\mathop{F\text{e}}}\,\,\,+\,\,1\text{e} \\ & \overset{+5}{\mathop{N}}\,\,\,+\,\,3\text{e}\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align} \right.$
=> cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
=> hệ số cân bằng là: 3, 28, 9, 1, 14
Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hoá và môi trường trong phản ứng : FeO + HNO3 → Fe(NO3)3 + NO + H2O là bao nhiêu?
$\overset{+2}{\mathop{Fe}}\,O\text{ }+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\to \overset{+3}{\mathop{\text{ }Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O$
$\begin{matrix} \text{3x} \\ {} \\ \text{1x} \\\end{matrix}\left| \begin{align} & \overset{+2}{\mathop{F\text{e}}}\,\,\,\to \,\,\overset{+3}{\mathop{F\text{e}}}\,\,\,+\,\,1\text{e} \\ & \overset{+5}{\mathop{N}}\,\,\,+\,\,3\text{e}\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align} \right.$
=> cân bằng: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
=> Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hoá và môi trường là 1 : 9
Hệ số của HNO3 trong phản ứng: Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O : N2 = 2 : 3) là
$\overset{0}{\mathop{Zn}}\,\text{ }+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\to \overset{+2}{\mathop{\text{ }Zn}}\,{{\left( N{{O}_{3}} \right)}_{2}}+\text{ }{{\overset{+1}{\mathop{N}}\,}_{2}}O\text{ }+\text{ }{{\overset{0}{\mathop{N}}\,}_{2}}+\text{ }{{H}_{2}}O$
$\begin{matrix} \text{23x} \\ {} \\ \text{1x} \\\end{matrix}\left| \begin{align} & \overset{0}{\mathop{Zn}}\to \overset{+2}{\mathop{Zn}}+2\text{e} \\ & 10\overset{+5}{\mathop{N}}+46\text{e}\to2{{\overset{+1}{\mathop{N}}}_{2}}O+3{{\overset{0}{\mathop{N}}}_{2}} \\ \end{align} \right.$
+) Vì tỉ lệ mol của N2O : N2 là 2 : 3 => thêm 2 trước N2O và thêm 3 trước N2 sau đó tính tổng e nhận = 10.5 - 2.2.1 - 0 = 46
+) Chọn hệ số sao cho tổng e cho = tổng e nhận => nhân 23 ở quá trình cho e và nhân 1 ở quá trình nhận e
=> cân bằng: 23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2 + 28H2O
Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O
Với a, b, c, d, e là những số nguyên tối giản. Tổng (a+b) bằng?
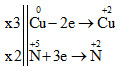
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tổng a + b = 3 + 8 = 11
Cho sơ đồ phản ứng: FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + 5NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của phản ứng là
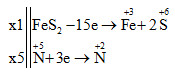
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số cân bằng của phản ứng là: 1 + 8 + 1 + 2 + 5 + 2 = 19
Cho sơ đồ phản ứng: K2MnO4 + H2O → KMnO4 + MnO2 + KOH. Tỉ lệ số phân tử K2MnO4 bị oxi hóa và bị khử là
Các quá trình nhường – nhận electron:
Mn6+ → Mn7+ + 1e | x2 (quá trình oxi hóa)
Mn6+ + 2e → Mn4+ | x1 (quá trình khử)
⟹ Tỉ lệ Mn6+ bị oxi hóa và Mn6+ bị khử hay tỉ lệ số phân tử K2MnO4 bị oxi hóa và bị khử là 2 : 1.
Cho phương trình hóa học: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O. Cho các phát biểu sau:
(1) Chất khử là Cu, chất oxi hóa là HNO3.
(2) Qúa trình khử là \(Cu \to C{u^{ + 2}} + 2e\).
(3) Số phân tử HNO3 bị khử là 2.
(4) Các nguyên tố có sự thay đổi số oxi hóa là Cu, H, N.
Số phát biểu đúng là
Số oxi hóa của nguyên tố thay đổi số oxi hóa được biểu diễn:
\(3\mathop {Cu}\limits^0 {\rm{ }} + {\rm{ }}8H\mathop N\limits^{ + 5} {O_3} \to 3\mathop {Cu}\limits^{ + 2} {\left( {N{O_3}} \right)_2} + {\rm{ }}2\mathop N\limits^{ + 2} O{\rm{ }} + {\rm{ }}4{H_2}O\)
\(\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e\) : quá trình oxi hóa (Cu nhường e nên là chất khử)
\(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \) : quá trình khử (HNO3 có \(\mathop N\limits^{ + 5} \)nhận e nên là chất oxi hóa)
Do \(\mathop N\limits^{ + 5} \) trong HNO3 bị Cu khử xuống \(\mathop N\limits^{ + 2} \)trong NO nên số phân tử HNO3 bị khử chính bằng số phân tử NO và bằng 2
⇒ Phát biểu đúng: (1), (3)
Cho các chất và ion sau: CO, C, CO2, CO32-, HCO3-. Số chất và ion mà C có cùng số oxi hóa là
Với CO2: Gọi số oxi hóa của C trong hợp chất bằng x
⇒ 1.x+2.(-2)=0 ⇒ x=+4
Với CO: Gọi số oxi hóa của C trong hợp chất là y
⇒ 1.x + 1.(-2) = 0 ⇒ x=+2
Với C: số oxi hóa là 0
Với CO32-: Gọi số oxi hóa của C trong ion là z
⇒ 1.z + 3.(-2) = -2 ⇒ z=+4
Với HCO3-: Gọi số oxi hóa của C trong ion là t
⇒ 1.(+1) + 1.t + 3.(-2) = -1 ⇒ x=+4
Vậy có 3 hợp chất và ion có cùng số oxi hóa của C là CO2, CO32-, HCO3-
Cho các chất và ion sau: ClO4-, ClO-, Cl2, ClO3-. Thứ tự theo chiều tăng dần về số oxi hóa của Cl là
Với ClO4-: Gọi số oxi hóa của Cl là x
⇒ 1.x + 4.(-2) = -1 ⇒ x = +7
Với ClO3-: Gọi số oxi hóa của Cl là y
⇒ 1.x + 3.(-2) = -1 ⇒ x = +5
Với ClO-: Gọi số oxi hóa của Cl là z
⇒ 1.x + 1.(-2) = -1 ⇒ x = +1
Với Cl2: Số oxi hóa của Cl là 0
⇒ Thứ tự theo chiều tăng dần về số oxi hóa của Cl là Cl2, ClO-, ClO3-, ClO4-
Dãy chất đều có nguyên tố có số oxi hóa +4 là
Với CO2: Gọi số oxi hóa của C trong hợp chất bằng x
⇒ 1.x+2.(-2)=0 ⇒ x=+4
Với HCO3-: Gọi số oxi hóa của C trong ion là y
⇒ 1.(+1) + 1.y + 3.(-2) = -1 ⇒ y=+4
Với SO2: Gọi số oxi hóa của S trong hợp chất bằng z
⇒ 1.z+2.(-2)=0 ⇒ z=+4
Với H2SO3: Gọi số oxi hóa của S trong hợp chất bằng t
⇒ 2.(+1) + 1.t + 3.(-2) = 0 ⇒ t=+4
Dãy chất đều có nguyên tố có số oxi hóa +4 là CO2, HCO3-, SO2, H2SO3.
Xét phản ứng: \(Fe + HN{O_3} \to F{e^{3 + }} + X + {H_2}O\). X là chất nào để tổng số electron Fe nhường là 24?
Với X là N2O
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\(\mathop {Fe}\limits^0 {\rm{ \;}} + H\mathop {{\rm{ }}N}\limits^{ + 5} {O_3} \to F{e^{3 + }} + \mathop {{N_2}}\limits^{ + 1} O + {H_2}O\)
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop {2N}\limits^{ + 5} + 8e \to \mathop {2N}\limits^{ + 1} }\\{\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} + 3e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
⇒ Với X là N2O thì tổng số electron Fe nhường là 3.8=24
Cho phản ứng hóa học sau:
\(Cu + {H_2}S{O_4} \to CuS{O_4} + {H_2}S + {H_2}O\)
Một bạn học sinh thực hiện các bước sau để cân bằng phản ứng trên:
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\) \({S^{ + 6}} + 4e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
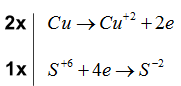
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2Cu + 3{H_2}S{O_4} \to 2CuS{O_4} + {H_2}S + 3{H_2}O\)
Tuy nhiên phương trình này chưa được cân bằng.
Nội dung của nguyên tắc thăng bằng electron mà bạn học sinh sử dụng ở trên là như thế nào?
Nội dung của nguyên tắc thăng bằng electron: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.

