Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
Từ Li đến F, các nguyên tố thuộc cùng chu kì, điện tích tăng dần thì bán kính nguyên tử giảm, độ âm điện tăng.
Anion ${X^ - }$ và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
${X^ - }$ : [Ne]3s23p6 $ \to $ X: [Ne]3s23p5 (Z = 17) $ \to $ X có số thứ tự 17, chu kì 3, nhóm VIIA
Y2+: [Ne]3s23p6 $ \to $ Y: [Ar]4s2 (Z = 20) $ \to $ X có số thứ tự 20, chu kì 4, nhóm IIA
Cấu hình electron của ion X3+ là 1s22s22p63s23p63d5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
X3+: 1s22s22p63s23p63d5
Vì nguyên tử X mất 3e tạo thành ion X3+
=> Cấu hình X: 1s22s22p63s23p63d64s2
$ \to $ X thuộc chu kì 4, nhóm VIIIB
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Y có mức năng lượng 3p và có 1 electron lớp ngoài cùng
=> Cấu hình electron Y: 4s1
=> Cấu hình của Y là [Ar]4s1
=> ZY = 19.
=> có 1 electron ở lớp ngoài cùng => Y là kim loại.
Nguyên tử X và Y có số electron hơn kém nhau là 2 và mức năng lượng cao nhất của X là 3p. => ZX = 19-2 =17
=> Cấu hình của X là [Ne]3s23p5
=> có 7 electron ở lớp ngoài cùng => X là phi kim.
Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
TH1: Nếu X, Y thuộc chu kì 2, 3
$\begin{gathered}\to \left\{ \begin{gathered}{Z_X} + {Z_Y} = 51 \hfill \\{Z_Y} - {Z_X} = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{Z_X} = 25 \hfill \\{Z_Y} = 26 \hfill \\ \end{gathered} \right. \hfill \\\to \left\{ \begin{gathered}X:{\text{[Ar}}]3{d^5}4{s^2} \hfill \\Y:{\text{[Ar}}]3{d^6}4{s^2} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→ nhóm B → loại
TH2: Nếu X, Y thuộc chu kì 4, 5 ,6, 7
$\begin{gathered} \to \left\{ \begin{gathered}{Z_X} + {Z_Y} = 51 \hfill \\{Z_Y} - {Z_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{Z_X} = 20 \hfill \\{Z_Y} = 31 \hfill \\ \end{gathered} \right. \hfill \\\to \left\{ \begin{gathered}X:{\text{[Ar}}]4{s^2} \hfill \\Y:{\text{[Ar}}]3{d^{10}}4{s^2}4{p^1} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→ nhóm A → X là Ca , Y là Ga → B, C, D sai
A đúng vì trong dung dịch Ca kết hợp với nước tạo dung dịch Ca(OH)2 chứ không khử ion Cu2+ trong dung dịch: Ca + 2H2O $\xrightarrow{{}}$ Ca(OH)2 + H2↑
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hydrogen là RH3. Trong oxide mà R có hóa trị cao nhất thì oxygen chiếm 74,07% về khối lượng. Nguyên tố R là
Hợp chất của nguyên tố R với H là RH3
=> R thuộc nhóm VA
=> oxide cao nhất của R là R2O5
Ta có:
$\% O = \dfrac{{16.5}}{{16.5 + 2R}} \cdot 100\% = 74,07\% \Rightarrow \,R = 14$
→ R là Nitrogen
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hydrogen, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxide cao nhất là
X có cấu hình electron lớp ngoài cùng là ns2np4
=> X thuộc nhóm IVA
=> hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có :
$\dfrac{X}{{X + 2}} \cdot 100\% = 94,12\% \to X = 32$
=> X là lưu huỳnh
Oxide cao nhất của S là SO3
=>$\% {m_S} = \dfrac{{32}}{{80}} \cdot 100\% = 40\% $
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hydrogen và trong oxide cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
Gọi công thức phân tử của R với H là RHx → oxide cao nhất tương ứng có dạng R2O8-x
Ta có: Phần trăm về khối lượng của R trong công thức với Hydrogen và trong công thức oxide cao nhất là: $\begin{gathered}a = \dfrac{R}{{R + x}} \cdot 100\% \,\,;\,\,b = \dfrac{{2R}}{{2R + 16.(8 - x)}} \cdot 100\% \, \hfill \\\to \dfrac{a}{b} = \dfrac{{2R + 16.(8 - x)}}{{2(R + x)}} = \dfrac{{11}}{4} \Leftrightarrow 14R + 86x = 512 \to \left\{ \begin{gathered}x = 4 \hfill \\R = 12 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→R là carbon. Oxide cao nhất của C là CO2 : O = C = O (phân tử không phân cực).
→ A đúng
B sai do CO2 ở điều kiện thường là chất khí.
C sai do Carbon thuộc chu kì 2.
D sai do Carbon (ở trạng thái cơ bản): 6C: 1s22s22p2 → có 4 electron s và 2 electron p
Nguyên tố Y là phi kim thuộc chu kỳ 3, có công thức oxide cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là
Y có công thức oxide cao nhất là YO3
=> Y thuộc nhóm VIA
Mà Y thuộc chu kì 3 => Y là S
Trong phân tử MS có: $\% M = \dfrac{M}{{M + 32}} \cdot 100\% = 63,64\% \to M = 56$
Vậy M là Fe
Cho các nguyên tố sau: Na (Z=11), Al (Z=13), Cl (Z=17). Phát biểu nào sau đây không đúng?
Na (Z=11): 1s22s22p63s1 => Ô số 11, chu kì 3, nhóm IA
Al (Z=13): 1s22s22p63s23p1 => Ô số 13, chu kì 3, nhóm IIIA
Cl (Z=17): 1s22s22p63s23p5=> Ô số 17, chu kì 3, nhóm VIIA
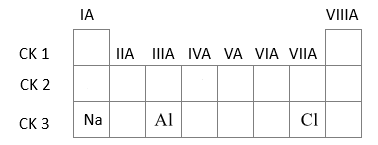
Nhận thấy cả 3 nguyên tố đều cùng thuộc chu kì 3 nhưng khác nhóm
Trong một chu kì theo chiều tăng dần điện tích hạt nhân
- độ âm điện tăng dần => Thứ tự tăng dần về độ âm điện là Na<Al<Cl (A đúng)
- bán kình nguyên tử giảm dần => Thứ tự giảm dần về bán kính nguyên tử là Na>Al>Cl (B đúng)
- tính base của các oxide giảm dần => Thứ tự tăng dần về tính base là Cl2O7<Al2O3<Na2O (C đúng)
- tính acid của hydroxide tăng dần => Thứ tự tăng dần về tính acid là NaOH<Al(OH)3<HClO4 (D sai)
Oxide ứng với hóa trị cao nhất của một số nguyên tố có công thức thực nghiệm là R2O5. Oxide này là một chất hút nước mạnh, được sử dụng trong tổng hợp chất hữu cơ. Khả năng hút ẩm của nó đủ mạnh để chuyển nhiều acid vô cơ thành các alhydrit (oxide tương ứng) của chúng. Hợp chất khí của R với hydrogen có chứa 8,82% khối lượng hydrogen và là chất khí không màu, rất độc, kém bền, sinh ra trong quá trình phân hủy xác động thực vật.
Phát biểu nào sau đây không đúng?
Oxide ứng với hóa trị cao nhất của một số nguyên tố có công thức thực nghiệm là R2O5
=> R thuộc nhóm VA (B đúng) => R là một phi kim (A đúng)
R có 5 electron lớp ngoài cùng => Cấu hình electron lớp ngoài cùng của R biểu diễn dưới dạng orbital là
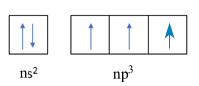
=> C sai
=> Hợp chất khí của R với hydrogen là RH3
=> Phần trăm khối lượng hydrogen bằng \(\dfrac{{3{M_H}}}{{{M_{R{H_5}}}}}.100\% = \dfrac{3}{{R + 3}}.100\% = 8,82\% = > R \simeq 31\)
=> R là Phosphorus (P)
=> Phần trăm về khối lượng của R trong R2O5 là \(\dfrac{{2.31}}{{2.31 + 5.16}}.100\% \simeq 43,66\% \) (D đúng)
Hòa tan hết 2,3 gam hỗn hợp có chứa kim loại barium và hai kim loại kiềm kế tiếp nhau trong nhóm IA của bảng tuần hoàn vào nước, thu được dung dịch X và 611 ml khí (25oC và 1 bar). Nếu thêm 1,278 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc vẫn còn ion Ba2+. Nếu thêm 1,491 gam Na2SO4 vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc có mặt ion SO42-. Hai kim loại kiềm là
Ở 25oC và 1 bar, số mol của khí H2 là \(\dfrac{{0,611}}{{24,79}} \simeq 0,025\)mol
Kí hiệu hai kim loại kiềm kế tiếp là M
PTHH:
\(\begin{array}{l}Ba + 2{H_2}O \to Ba{(OH)_2} + {H_2}\\2M + 2{H_2}O \to 2MOH + {H_2}\\Ba{(OH)_2} + N{a_2}S{O_4} \to BaS{O_4} + 2NaOH\end{array}\)
Khi thêm 1,278 gam Na2SO4 (0,009 mol) do sau khi phản ứng kết thúc nước lọc vẫn còn Ba2+ => Ba2+ dư => Số mol Ba = Số mol Ba2+ > 0,009 mol
Khi thêm 1,491 gam Na2SO4 (0,0105 mol) vào dung dịch X và khuấy đều thì sau khi phản ứng kết thúc, nước lọc có mặt ion SO42- => SO42- dư => Số mol Ba = Số mol Ba2+ < 0,0105 mol
Gọi số mol của Ba và M lần lượt là a mol và b mol
=> 0,009 <a<0,0105 (*)
Dựa vào khối lượng hỗn hợp: 137a + Mb =2,3 (1)
Dựa vào số mol H2: a + 0,5b = 0,025 (2)
Từ (2)=>a=0,025–0,5b (mol) thay vào (*) ta được 0,009<0,025-0,5b<0,0105
=> 0,029<b<0,032 (**)
(1) => 137.(0,025-0,5b) + Mb = 2,3 => b = \(\dfrac{{1,125}}{{68,5 - M}}\)thay vào (**)
=> 0,029<\(\dfrac{{1,125}}{{68,5 - M}}\)<0,032 => 29,71<M<33,34 => Hai kim loại thỏa mãn là sodium (Na, M=23) và potassium (K, M=39)
Kim loại M thuộc nhóm IIA của bảng tuần hoàn, là một thành phần dinh dưỡng quan trọng. Sự thiếu hụt rất nhỏ của nó đã ảnh hưởng tới sự hình thành và phát triển của xương và răng. Thừa M có thể dẫn đến sỏi thận. Cho 0,8 gam M tác dụng hết với dung dịch HCl, thu được 0,4958 lít khí đo ở 25oC và 1 bar. Cho số hiệu nguyên tử của Ca, K và Mg lần lượt là 20, 19 và 12. Phát biểu nào sau đây không đúng?
PTHH: \(M + 2HCl \to MC{l_2} + {H_2}\)
Từ phương trình => \({n_M} = {n_{{H_2}}} = \dfrac{{0,4958}}{{24,79}} = 0,02\)mol => M=\(\dfrac{{0,8}}{{0,02}} = 40\)=> M là Ca (A đúng)
Ca (Z=20): 1s22s22p63s23p64s2 => Ô số 20, chu kì 4, nhóm IIA
K (Z=19): 1s22s22p63s23p64s1 => Ô số 19, chu kì 4, nhóm IA
Mg (Z=12): 1s22s22p63s2 => Ô số 12, chu kì 3, nhóm IIA
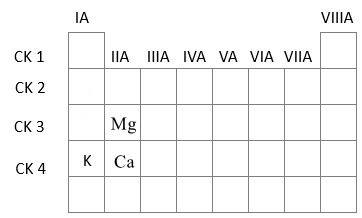
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần => K có tính kim loại mạnh hơn Ca
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần => Ca có tính kim loại mạnh hơn Mg
=> Thứ tự tính kim loại tăng dần là Mg<Ca<K (B đúng)
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần => Ca có độ âm điện lớn hơn K
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần => Mg có độ âm điện lớn hơn Ca
=> Thứ tự độ âm điện giảm dần là Mg>Ca>K (C sai)
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tính base của hydroxide giảm dần => KOH có tính base mạnh hơn Ca(OH)2 (D đúng)
Cation R3+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phát biểu nào sau đây không đúng?
Cấu hình electron của R3+: 1s22s22p6
R nhường 3 electron tạo R3+ => Cấu hình electron của R: 1s22s22p63s23p1
Cấu hình electron lớp ngoài cùng của R được biểu diễn dưới dạng orbital là
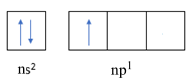
=> R có 1 electron độc thân (A sai)
R ở ô số 13, chu kì 3, nhóm IIIA (D đúng)
=> Oxide ứng với hóa trị cao nhất của R là R2O3 (B đúng)
R là một kim loại vì có 3e ở lớp ngoài cùng (C đúng)
Một nguyên tử X có tổng số các hạt là 108. Số hạt mang điện nhiều hơn số hạt không mang điện là 24 hạt. Phát biểu nào sau đây không đúng?
X có tổng số các hạt là 108 => 2p + n = 108 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 24 hạt => 2p – n = 24 (2)
Từ (1) và (2) => p = 33 và n = 42
Cấu hình electron của X là: 1s22s22p63s23p63d104s24p3 => Ô số 33, chu kì 4, nhóm VA (A đúng)
X là một phi kim vì có 5e ở lớp ngoài cùng (B đúng)
X là nguyên tố p (C sai)
Hydroxide tương ứng của X là HXO3 (D đúng)
Các nguyên tố X, Y, M, T có số hiệu nguyên tử lần lượt là 6, 9, 14, 17. Phát biểu nào sau đây không đúng?
X (Z=6): 1s22s22p2 => Ô số 6, chu kì 2, nhóm IVA
Y (Z=9): 1s22s22p5=> Ô số 9, chu kì 2, nhóm VIIA
M (Z=14): 1s22s22p63s23p2 => Ô số 14, chu kì 3, nhóm IVA
T (Z=17): 1s22s22p63s23p5 => Ô số 17, chu kì 3, nhóm VIIA
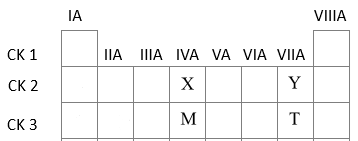
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần => X có tính kim loại mạnh hơn Y
Trong một nhóm theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần => M có tính kim loại mạnh hơn X
=> Thứ tự tính kim loại tăng dần là Y<X<M (A đúng)
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, độ âm điện tăng dần => Y có độ âm điện lớn hơn X (B đúng)
X và T là 2 nguyên tố ở hai chu kì liên tiếp nhưng khác nhóm (C đúng)
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid tăng dần => MO2 có tính acid yếu hơn T2O7 (D sai)
Nguyên tử M có Z=23. Vị trí của M trong bảng tuần hoàn là
M (Z=23): 1s22s22p63s23p63d34s2 => Ô số 23, chu kì 4, nhóm VB
Ion M3+ có phân lớp electron ngoài cùng là 3d5. Ion Y- có cấu hình electron ngoài cùng là 4p6. Phát biểu nào sau đây không đúng?
M3+ có phân lớp electron ngoài cùng là 3d5 => Cấu hình electron của M3+: 1s22s22p63s23p63d54s2
Từ M nhường 3e tạo M3+ => Cấu hình electron của M: 1s22s22p63s23p63d84s2 (D đúng)
=> M ở ô số 28, chu kì 4, nhóm VIIIB (A sai)
Y- có cấu hình electron ngoài cùng là 4p6
=> Cấu hình electron của Y-: 1s22s22p63s23p63d104s24p6
Từ Y nhận 1e tạo Y- => Cấu hình electron của Y: 1s22s22p63s23p63d104s24p5
=> Y ở ô số 35, chu kì 4, nhóm VIIA
B đúng vì electron cuối cùng của Y được điền vào phân lớp 4p
C đúng
Ba nguyên tố với số hiệu nguyên tử Z=11, Z=12, Z=13 có hydroxide tương ứng là X, Y, T. Chiều giảm dần tính acid của các hydroxide này là
Z=11: 1s22s22p63s1 => Ô số 11, chu kì 3, nhóm IA
Z=12: 1s22s22p63s2 => Ô số 12, chu kì 3, nhóm IIA
Z=13: 1s22s22p63s23p1 => Ô số 13, chu kì 3, nhóm IIIA
Nhận thấy cả 3 nguyên tố trên đều cùng thuộc chu kì 3
=> Vị trí các hydroxide X, Y, T tương ứng trong BTH là
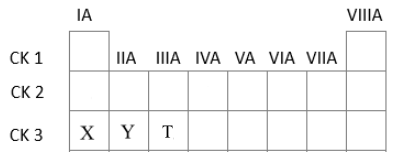
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide tăng dần
=> Thứ tự giảm dần tính acid của các hydroxide là T, Y, X
Cho các nguyên tố sau: 14Si, 15P và 16S
Phát biểu nào sau đây không đúng?
14Si: 1s22s22p63s23p2 => Ô số 14, chu kì 3, nhóm IVA
15P: 1s22s22p63s23p3 => Ô số 15, chu kì 3, nhóm VA
16S: 1s22s22p63s23p4 => Ô số 16, chu kì 3, nhóm VIA
Nhận thấy 3 nguyên tố trên cùng thuộc chu kì 3
A đúng vì electron cuối cùng của cả 3 nguyên tố trên đều điền ở phân lớp p
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính phi kim tăng dần
=> Thứ tự giảm dần tính phi kim là S, P, Si (B đúng)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính base của oxide giảm dần
=> Thứ tự tính base tăng dần là SO3, P2O5, SiO2 (C sai)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid của hydroxide tăng dần
=> Thứ tự tăng dần tính acid của hydroxide là H2SiO3, H3PO4, H2SO4 (D đúng)

