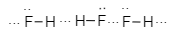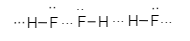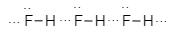Bài 13: Liên kết hydrogen và tương tác van der Waals
Sách kết nối tri thức với cuộc sống
Liên kết hydrogen được hình thành
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn còn cặp electron hóa trị chưa tham gia liên kết).
Sơ đồ nào biểu diễn liên kết hydrogen giữa phân tử hydrogen fluoride (HF) với nhau?
Sơ đồ biểu diễn liên kết hydrogen giữa phân tử hydrogen fluoride (HF) với nhau là

Chất nào sau đây có thể tạo liên kết hydrogen với chính nó?
A, C sai vì không có H
B sai vì không có X với Y
D đúng

Phát biểu nào không đúng?
Liên kết hydrogen yếu hơn liên kết cộng hóa trị và liên kết ion.
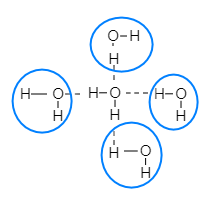
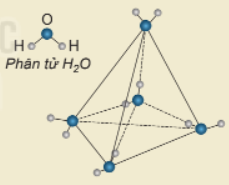
Một phân tử nước có thể tạo ra bao nhiêu liên kết hydrogen với các phân tử nước khác xung quanh?
Nguyên tử O có 2 cặp electron chưa liên kết nên có thể tạo 2 liên kết hydrogen với 2 nguyên tử H của các phân tử nước khác. 2 nguyên tử H của phân tử nước đủ điều kiện để tạo liên kết hydrogen với 2 nguyên tử O của các phân tử nước khác.
⇒ Một phân tử nước có thể tạo ra 4 liên kết hydrogen với các phân tử nước khác xung quanh tạo thành cấu trúc tứ diện.
Liên kết hydrogen và tương tác van der Waals đều làm thay đổi nhiệt độ sôi, nhiệt độ nóng chảy của các chất như thế nào?
Liên kết hydrogen và tương tác van der Waals đều làm tăng nhiệt độ sôi, nhiệt độ nóng chảy của các chất
Phát biểu nào sau đây không đúng khi nói về tương tác Van der Waals?
C sai. Tương tác Van der Waals được tạo thành bởi tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử hay phân tử.
Tại sao ở điều kiện thường H2S (M=34) là chất khí trong khi H2O (M=18) là chất lỏng?
- Trong phân tử H2O có liên kết O-H nên tạo được liên kết hidro giữa các phân tử:

Do đó cần năng lượng khá cao dưới dạng nhiệt để phá vỡ các liên kết hydrogen trước khi chuyển nước từ lỏng sang hơi
⇒ Độ sôi của nước cao hơn độ sôi của H2S tuy rằng phân tử lượng của H2O nhỏ hơn so với H2S
Cho kí hiệu tổng quát của một liên kết hydrogen:
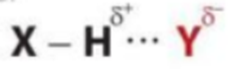
Trong đó: X, Y là các nguyên tử N, O, F
Liên kết hydrogen càng bền chặt khi
Liên kết hydrogen càng bền chặt khi phần điện tích dương trên H càng dương (X có độ âm điện càng lớn tức hút electron về phía X càng mạnh) và phần điện tích âm trên Y càng âm (Y có độ âm điện lớn)
Một lưỡng cực tạm thời được tạo thành khi có
Một lưỡng cực tạm thời được tạo thành khi có sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử.

Phát biểu nào sau đây đúng khi so sánh hai chất C2H5OH và CH3-O-CH3?
Do C2H5OH tạo được liên kết hydrogen với nhau
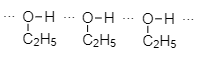
Do đó cần năng lượng khá cao dưới dạng nhiệt để phá vỡ các liên kết hydrogen trước khi chuyển C2H5OH từ lỏng sang hơi.
⇒ Độ sôi của C2H5OH lớn hơn CH3-O-CH3.
Cho ba chất C2H5OH, HCOOH, CH3COOH và các giá trị nhiệt độ sôi là 118,20C; 78,30C; 100,50C. Hãy sắp xếp nhiệt độ sôi phù hợp vào đúng mỗi chất?
Chất nào tạo được nhiều liên kết hydrogen trong phân tử thì có nhiệt độ sôi cao
Một phân tử C2H5OH tạo được 2 liên kết hydrogen với các phân tử C2H5OH xung quanh
Một phân tử HCOOH tạo được 3 liên kết hydrogen với các phân tử HCOOH xung quanh
Một phân tử CH3COOH tạo được 3 liên kết hydrogen với các phân tử CH3COOH xung quanh
⇒ Độ sôi của C2H5OH nhỏ hơn của HCOOH và CH3COOH
Có diện tích tiếp xúc giữa các phân tử trong CH3COOH lớn hơn trong HCOOH hay khối lượng mol của CH3COOH lớn hơn khối lượng mol của HCOOH
⇒ Độ sôi của HCOOH nhỏ hơn của CH3COOH
⇒ Thứ tự tăng dần về nhiệt độ sôi: C2H5OH, HCOOH, CH3COOH
Gán giá trị nhiệt độ: C2H5OH: 78,30C, HCOOH: 100,50C, CH3COOH: 118,20C.