Bài 17: Hydrogen halide và một số phản ứng của ion halide
Sách chân trời sáng tạo
Những hiđro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, NaBr, NaI là
Hiđro halogenua có thể là HF và HCl
Không thể là HBr và HI vì khí HBr và HI sinh ra phản ứng được với H2SO4 đặc nóng
Cho các phản ứng sau:
(1) Cl2 + 2NaBr → 2NaCl + Br2
(2) Br2 + 2NaI → 2NaBr + I2
(3) Cl2 + 2NaF → 2NaCl + F2
(4) Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(5) F2 (khô) + 2NaCl(nóng chảy) → 2NaF + Cl2
(6) HF + AgNO3 → AgF + HNO3
(7) HCl + AgNO3 → AgCl + HNO3
(8) PBr3 + 3H2O → H3PO3 + 3HBr
Số phương trình hóa học viết đúng là
Phản ứng đúng là : (1) (2) (4) (5) (7) (8)
Vì HF là axit yếu, không phản ứng để sinh ra axit mạnh được.
Phân biệt hai lọ mất nhãn đựng dung dịch NaF và dung dịch NaI chỉ cần dùng dung dịch
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là AgNO3.
Vì AgNO3 tạo kết tủa với các halogen (trừ F)
AgNO3 + NaI → AgI↓ + NaNO3
Phát biểu nào không đúng ?
Tính axit tăng dần: HF < HCl <HBr <HI
Mệnh đề không chính xác là
Mệnh đề không chính xác là: tất cả các muối AgX (X là halogen) đều không tan.
Vì AgF là muối tan
Cho dãy axit HF, HCl, HBr, HI. Theo chiều từ trái sang phải, tính chất axit biến đổi như sau:
$\xrightarrow{{HF\,\,\,\,\,\,\,\,\,\,\,HCl\,\,\,\,\,\,\,\,\,\,\,\,HB{\text{r}}\,\,\,\,\,\,\,\,\,\,\,\,HI}}$
Tính axit tăng dần, tính khử tăng dần
Trong phòng thí nghiệm, người ta thường bảo quản dung dịch HF trong bình làm bằng
Trong phòng thí nghiệm, người ta thường bảo quản dung dịch HF trong bình làm bằng nhựa
Cho dung dịch AgNO3 vào dung dịch muối nào sau đây không xảy ra phản ứng ?
Dung dịch AgNO3 không phản ứng với NaF
Trong muối NaCl có lẫn NaBr và NaI. Để loại 2 muối này ra khỏi NaCl, người ta có thể
Để loại 2 muối này ra khỏi NaCl, người ta cho dung dịch hỗn hợp tác dụng với khí Cl2 dư, sau đó cô cạn dung dịch.
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là AgNO3.
Vì AgNO3 tạo kết tủa với các halogen (trừ F)
Cho các phản ứng sau:
(1) NaOH + HCl → NaCl + H2O.
(2) K2CO3 + HCl → KCl + CO2 + H2O.
(3) MnO2 + HCl → MnCl2 + Cl2 + H2O.
(4) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
(5) Fe + HCl→ FeCl2 + H2.
(6) HCl + CuO →CuCl2 + H2O.
Số phản ứng HCl chỉ thể hiện tính oxi hoá là:
Clo chỉ thể hiện số oxi hóa khi chỉ có sự giảm số oxi hóa của nguyên tố clo hoặc hidro hoặc cả hai trong phản ứng
Xác định số oxi hóa của Clo và H trong HCl
\[\begin{array}{*{20}{l}}
{\left( 1 \right){\rm{ }}NaOH{\rm{ }} + {\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} {\rm{ }} \to \;Na\mathop {Cl}\limits^{ - 1} {\rm{ }} + {\rm{ }}\mathop {{H_2}}\limits^{ - 1} O.}\\
{\left( 2 \right){\rm{ }}{K_2}C{O_3} + {\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} \to {\rm{ }}\;K\mathop {Cl}\limits^{ - 1} + {\rm{ }}C{O_2} + {\rm{ }}\mathop {{H_2}}\limits^{ - 1} O.}\\
{\left( 3 \right){\rm{ }}Mn{O_2} + {\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} {\rm{ }} \to \;Mn\mathop {C{l_2}}\limits^{ - 1} + {\rm{ }}\mathop {C{l_2}}\limits^0 + {\rm{ }}\mathop {{H_2}}\limits^{ - 1} O.}\\
{\left( 4 \right){\rm{ }}KMn{O_4} + {\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} \to \;KCl{\rm{ }} + {\rm{ }}Mn\mathop {C{l_2}}\limits^{ - 1} + {\rm{ }}\mathop {C{l_2}}\limits^0 + {\rm{ }}\mathop {{H_2}}\limits^{ - 1} O.}\\
{\left( 5 \right){\rm{ }}Fe{\rm{ }} + {\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} {\rm{ }} \to \;Fe\mathop {C{l_2}}\limits^{ - 1} + {\rm{ }}\mathop {{H_2}}\limits^0 .}\\
{\left( 6 \right){\rm{ }}\mathop H\limits^{ - 1} \mathop {Cl}\limits^{ - 1} {\rm{ }} + {\rm{ }}CuO \to \;Cu\mathop {C{l_2}}\limits^{ - 1} + {\rm{ }}\mathop {{H_2}}\limits^{ - 1} O.}
\end{array}\]
=> Phản ứng (5) là số oxi hóa của H bị giảm từ +1 xuống 0
Cho giá trị nhiệt độ sôi của các hydrogen halide không theo thứ tự: +19,5oC, -35,8oC, -84,9oC và -66,7oC. Đâu là sự sắp xếp giá trị nhiệt độ sôi tương ứng đúng với các hydrogen halide?
Nhiệt độ sôi của hydrogen halide giảm từ HF đến HCl và tăng từ HCl đến HI
=> HF: +19,5oC; HCl: -84,9oC; HBr: -66,7oC; HI: -35,8oC.
Cho các phát biểu sau:
(1) Từ HF đến HI, tính acid tăng dần.
(2) Acid HCl thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate bám trên bề mặt kim loại trước khi sơn, hàn, mạ điện dựa trên tính acid của HCl.
(3) Trong công nghiệp, hỗn hợp gồm KF và HF (có tỉ lệ mol tương ứng 3:1) được dùng để điện phân nóng chảy sản xuất fluorine.
(4) Acid HF phân li hoàn toàn trong nước, còn các acid HCl, HBr, HI phân li một phần trong nước.
Số phát biểu sai là
(3) sai. Trong công nghiệp, hỗn hợp gồm KF và HF (có tỉ lệ mol tương ứng 1:3) được dùng để điện phân nóng chảy sản xuất fluorine.
(4) sai. Từ HF đến HI, tính acid tăng dần nên HF phân li một phần, còn HCl, HBr, HI phân li hoàn toàn trong nước
Sục khí clo (Cl2) dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam so với ban đầu. Lượng clo (Cl2) đã tham gia phản ứng là:
Gọi số mol Cl2 phản ứng là x
Tổng quát : Cl2 + 2Br- -> Br2 + 2Cl-
Mol x -> 2x -> 2x
=> mmuối giảm = mBr- - mCl- = 80.2x – 35,5.2x = 4,45
=> x = 0,05 mol
Cho các phản ứng sau:
\(KCl + {H_2}S{O_4} \to KHS{O_4} + HCl \uparrow \) (1)
$CaC{l_2}\xrightarrow{{dpnc}}Ca + C{l_2} \uparrow $ (2)
\(2HI + N{a_2}O \to 2NaI + {H_2}O\) (3)
\(2HBr + {H_2}S{O_4} \to B{r_2} + S{O_2} + 2{H_2}O\) (4)
\(6KI + 4{H_2}S{O_4} \to 3{I_2} + S + 3{K_2}S{O_4} + 4{H_2}O\) (5)
Số phương trình thể hiện tính khử của các ion halogen là
Đáp án C
Dung dịch NaCl bị lẫn NaI. Để làm sạch dung dịch NaCl có thể dùng:
Dùng Cl2 sẽ có phản ứng :
Cl2 + 2NaI -> 2NaCl + I2
=> sau phản ứng chỉ có NaCl mà không có muối khác. I2 không tan trong nước cũng dễ lọc tách.
Thêm 78 ml dung dịch AgNO3 10% (D=1,09 g/ml) vào dung dịch có chứa 3,88 g hỗn hợp KBr và NaI. Lọc bỏ kết tủa. Nước lọc phản ứng vừa đủ với 13,3 ml dung dịch HCl 1,5 M. Phần trăm khối lượng KBr trong hỗn hợp muối ban đầu là
\({m_{{\rm{dd AgN}}{{\rm{O}}_3}}} = D.V = 1,09.78 = 85,02g\)
\(C\% = \frac{{{m_{AgN{O_3}}}}}{{{m_{{\rm{dd}}AgN{O_3}}}}}.100\% \Leftrightarrow 10\% = \frac{{{m_{AgN{O_3}}}}}{{85,02}}.100\% \Leftrightarrow {m_{AgN{O_3}}} = 8,502g \Leftrightarrow {n_{AgN{O_3}}} = 0,05mol\)(lượng ban đầu)
\(\begin{array}{l}\begin{array}{*{20}{c}}{KBr}\\x\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\x\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{KN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgBr}\\{}\end{array}\\\begin{array}{*{20}{c}}{NaI}\\y\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{AgN{O_3}}\\y\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{AgI}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{NaN{O_3}}\\{}\end{array}\end{array}\)
Phần nước lọc phản ứng tác dụng với dung dịch HCl ⇒ AgNO3 còn dư
\({C_{M(HCl)}} = \dfrac{{{n_{HCl}}}}{{{V_{{\rm{dd}}HCl}}}} \Leftrightarrow 1,5 = \frac{{{n_{HCl}}}}{{13,{{3.10}^{ - 3}}}} \Leftrightarrow {n_{HCl}} \simeq 0,02mol\)
\(\begin{array}{*{20}{c}}{AgN{O_3}}\\{0,02}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HCl}\\{0,02}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{AgCl}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HN{O_3}}\\{}\end{array}\)
Ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{c}}{119x + 150y = 3,88}\\{x + y + 0,02 = 0,05}\end{array} \Leftrightarrow \left\{ {\begin{array}{*{20}{c}}{x = 0,02}\\{y = 0,01}\end{array}} \right.} \right.\)
Phần trăm khối lượng của KBr=\(\dfrac{{0,02.119}}{{3,88}}.100\% \simeq 61,34\% \)
Cho các dung dịch sau: NaCl, KI, Mg(NO3)2, AgNO3. Chỉ dùng thuốc thử duy nhất là dung dịch HCl thì nhận biết được bao nhiêu dung dịch trên?

\(AgN{O_3} + NaCl \to AgCl \downarrow + NaN{O_3}\)
\(AgN{O_3} + KI \to AgI \downarrow + KN{O_3}\)
Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaY trong hỗn hợp ban đầu là
+) TH1 : Nếu hỗn hợp đầu là NaF và NaCl
=> kết tủa chỉ có AgCl (Vì AgF tan) => nAgCl = 0,06 mol = nNaCl
=> nNaF = 0,06 mol
=> %mNaCl = 58,2%
+) TH2 : Nếu không có NaF
Gọi chung hai muối natri là NaZ với số mol là x mol
Ta có :\(6,03gam\left\{ {\begin{array}{*{20}{l}}{NaX}\\{NaY}\end{array}} \right.\) $\xrightarrow{AgN{{O}_{3}}}$ \(8,61gam\left\{ {\begin{array}{*{20}{l}}{NaX}\\{NaY}\end{array}} \right.\)
Sử dụng phương pháp tăng giảm=> mtăng = mAg - mNa = x.108 – x.23=8,61-6,03
=> x = 0,0304
=> MNaZ= \(\frac{m}{n} = \frac{{6,03}}{{0,034}} = 198,66\)
=> MZ = 175,66
=> Không có các giá trị thỏa mãn.
Cho các phản ứng sau:
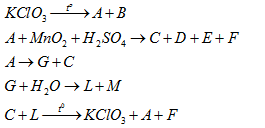
Cho các phát biểu sau:
(1) B là khí không màu, nặng hơn không khí, ít tan trong nước và duy trì sự cháy.
(2) Cả 5 phản ứng trên đều thuộc phản ứng oxi hóa – khử.
(3) 1 mol G tác dụng với nước tạo 0,5 mol khí H2.
(4) L làm quỳ ẩm chuyển màu xanh.
Số phát biểu đúng là
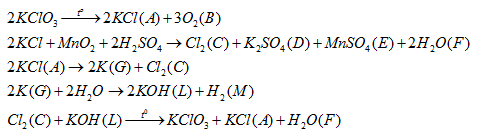
Cả 4 phát biểu đều đúng

