Phân tử HCl (hydrogen chloride) được tạo thành bởi liên kết cộng hóa trị. Mô tả nào sau đây đúng khi nói về sự tạo thành phân tử HCl?
Nguyên tử H có 1 electron ở lớp ngoài cùng, nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để đạt đến cấu hình của khí hiếm gần nhất, hai nguyên tử H và Cl đã liên kết với nhau bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl.
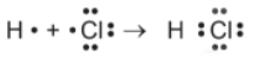
Để tuân theo quy tắc octet, các nguyên tử trong chất có liên kết cộng hóa trị liên kết với nhau bằng
Để tuân theo quy tắc octet, các nguyên tử trong chất có liên kết cộng hóa trị liên kết với nhau bằng việc sử dụng các cặp electron dùng chung.
Cho sơ đồ mô tả sự dùng chung cặp electron giữa hai nguyên tử chlorine tạo thành phân tử chlorine:
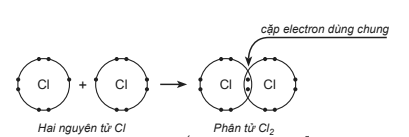
Số electron hóa trị và số electron đóng góp cho sự dùng chung của mỗi nguyên tử chlorine là
Mỗi nguyên tử Cl có 7 electron hóa trị, trong đó có 1 electron độc thân đóng góp vào cặp electron dùng chung
Phát biểu nào sau đây không đúng khi nói về liên kết cộng hóa trị?
Các nguyên tử khi tham gia liên kết hay phản ứng với mục đích đạt đến cấu hình của khí hiếm bền vững (quy tắc octet) nên cả liên kết ion và liên kết cộng hóa trị đều tuân theo quy tắc octet
Liên kết cho – nhận là
Liên kết cho – nhận là liên kết cộng hóa trị trong đó cặp electron dùng chung chỉ do một nguyên tử đóng góp.
Điều kiện để có liên kết cho – nhận là gì?
Điều kiện để có liên kết cho – nhận là có thành phần cho là nguyên tử có cặp electron chưa liên kết và thành phần nhận có orbital trống, không có electron.
Cặp electron liên kết trong liên kết cộng hóa trị phân cực và liên kết cộng hóa trị không phân cực có sự khác nhau là
Cặp electron liên kết trong liên kết cộng hóa trị phân cực và liên kết cộng hóa trị không phân cực có sự khác nhau là cặp electron liên kết trong liên kết cộng hóa trị phân cực bị lệch về phía nguyên tử có độ âm điện lớn hơn, còn cặp electron liên kết trong liên kết cộng hóa trị không phân cực không bị lệch về phía nguyên tử nào.
Thứ tự sự phân cực của liên kết theo chiều tăng dần là
Thứ tự sự phân cực của liên kết theo chiều tăng dần là liên kết cộng hóa trị không phân cực, liên kết cộng hóa trị phân cực, liên kết ion.
Cho giá trị độ âm điện tương đối theo Pauling của các nguyên tố sau: H (2,20); N (3,04); S (2,58); Al (1,61) và các chất NH3, H2S, AlH3, Al2S3. Số chất có liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực lần lượt là
Hiệu độ âm điện của
H với N: 3,04 – 2,20 = 0,84
H với S: 2,58 – 2,20 = 0,38
H với Al: 2,20 – 1, 61 = 0,59
Al với S: 2,58 – 1,61 = 0,97
| Hiệu độ âm điện (\(\Delta \chi \)) | Loại liên kết | Chất |
| 0\( \le \)\(\Delta \chi \)\( \le \)0,4 | Cộng hóa trị không phân cực | H2S |
| 0,4 \( \le \)\(\Delta \chi \)\( \le \)1,7 | Cộng hóa trị phân cực | NH3, AlH3, Al2S3 |
| \(\Delta \chi \)\( \ge \)1,7 | Ion |
Phát biểu nào không đúng về phân tử CO2?
Hiệu độ âm điện của C và O là: 3,44 – 2,55 = 0,89 => Liên kết giữa C với O là liên kết cộng hóa trị phân cực
Do phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi C=O triệt tiêu nhau, dẫn đến phân tử không bị phân cực

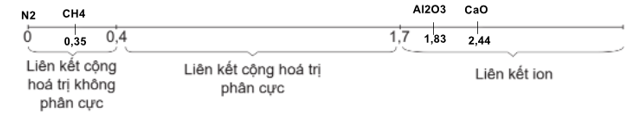
Cho giá trị âm điện tương đối theo Pauling của các nguyên tố sau: Ca (1,00); O (3,44); N (3,04); C (2,55); H (2,20); Al (1,61); Cl (3,16). Thứ tự theo chiều tăng độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, CH4, N2, Al2O3?
Hiệu của độ âm điện của
Ca với O: 3,44 – 1,00 = 2,44
C với H: 2,55 – 2,20 = 0,35
N với N: 0
Al với O: 3,44 – 1,61 = 1,83
| Hiệu độ âm điện (\(\Delta \chi \)) | Loại liên kết | Chất |
| 0\( \le \)\(\Delta \chi \)\( \le \)0,4 | Cộng hóa trị không phân cực | N2, CH4 |
| 0,4 \( \le \)\(\Delta \chi \)\( \le \)1,7 | Cộng hóa trị phân cực | |
| \(\Delta \chi \)\( \ge \)1,7 | Ion | CaO, Al2O3 |
Cho giá trị độ âm điện tương đối theo Pauling của các nguyên tố sau: F (3,98); Cl (3,16); Br (2,96); I (2,68) và H (2,20). Phân tử giữa halogen nào với hydrogen có độ phân cực nhất?
Hiệu độ âm của
H với F: 3,98 – 2,20 = 1,78
H với Cl: 3,16 – 2,20 = 0,96
H với Br: 2,96 – 2,20 = 0,76
H với I: 2,68 – 2,20 = 0,48
Hiệu độ âm điện của H và F lớn nhất nên độ phân cực của H và F lớn nhất
Liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital là
Liên kết sigma là liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital
Phân tử HCl có sự xen phủ
H: 1s1; Cl: 1s22s22p63s23p5
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình electron bền vững của nguyên tử khí hiếm He) và nguyên tử chlorine có 8 electron thỏa mãn quy tắc octet
Phân tử HCl tạo thành khi orbital 1s của nguyên tử H (1s1) xen phủ với orbital 3p của nguyên tử Cl (3s23p5) theo trục liên kết tạo liên kết cộng hóa trị giữa H và Cl
=> Sự xen phủ s – p
Liên kết đôi và liên kết ba đều có
Liên kết đơn được tạo bởi một liên kết \(\sigma \). Liên kết đôi gồm một liên kết \(\sigma \) và một liên kết \(\pi \). Liên kết ba gồm một liên kết \(\sigma \) và hai liên kết \(\pi \)
Vinyl axetilen có công thức cấu tạo là \(CH \equiv C - CH = C{H_2}\). Số liên kết sigma và liên kết pi lần lượt là
- Liên kết \(\sigma \) tạo bởi C với H là 4. Liên kết \(\sigma \) tạo bởi C với C là 3
=> Tổng liên kết \(\sigma \) là 7
- Liên kết \(\pi \) tạo bởi C với C là 2 (trong liên kết ba) + 1 (trong liên kết đôi) = 3
Năng lượng liên kết là
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí.
Năng lượng liên kết càng lớn thì
Năng lượng liên kết càng lớn thì liên kết càng bền
Năng lượng liên kết của phân tử F2 là 159 kJ/mol cho biết điều gì?
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí.
Cho năng lượng liên kết của liên kết C-H là 418 kJ/mol, của liên kết C=C là 612 kJ/mol. Tổng năng lượng liên kết trong phân tử C2H4 là
6C: 1s22s22p2
1H: 1s1
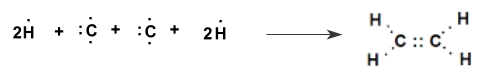
Công thức cấu tạo của C2H4
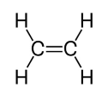
=> C2H4 có 1 liên kết C=C và 4 liên kết C-H
\( \Rightarrow E = {E_{C = C}} + 4{E_{C - H}} = 612 + 4.418 = 2284kJ/mol\)

