Bài 15: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Sách chân trời sáng tạo
Hình vẽ dưới mô tả sự ảnh hưởng của yếu tố nào đến tốc độ phản ứng giữa X với Y?

Sự khác nhau giữa hình a) và hình b) là kích thước của chất Y. Khi chất Y bị chia nhỏ ra thì khả năng va chạm với X lớn hơn (hình b) còn chất Y không bị chia nhỏ thì khả năng va chạm với X ít hơn (hình a)
=> Yếu tố ảnh hưởng đến tốc độ phản ứng là diện tích tiếp xúc
Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
Áp suất gây ảnh hưởng đến tốc độ phản ứng khi có chất khí tham gia phản ứng đó.
Phát biểu nào sau đây không đúng?
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
Cho phản ứng: \(CaC{O_3}(s) + 2HCl(aq) \to CaC{l_2}(aq) + C{O_2}(g) + {H_2}O(aq)\) và các biện pháp sau:
(1) Tăng nồng độ dung dịch HCl.
(2) Tăng áp suất.
(3) Giảm nhiệt độ.
(4) Nghiền nhỏ CaCO3.
Số biện pháp làm tăng tốc độ phản ứng là
Khi tăng các yếu tố là nồng độ, nhiệt độ, áp suất, bền mặt tiếp xúc thì làm tăng số va chạm hiệu quả, dẫn đến tốc độ phản ứng tăng.
Riêng áp suất chỉ đúng với phản ứng có chất khí, nhưng với trường hợp này chỉ có chất khí sinh ra nên áp suất không làm ảnh hưởng đến tốc độ phản ứng
=> Các biện pháp làm tăng tốc độ phản ứng: (1), (4)
Đâu là ứng dụng của ảnh hưởng của nhiệt độ lên tốc độ phản ứng?
Trong phòng thí nghiệm, người ta dùng đèn cồn đun nóng các chất là biện pháp sử dụng yếu tố nhiệt độ để làm tăng tốc độ phản ứng
Chất xúc tác là
Chất xúc tác là chất làm tăng tốc độ phản ứng, mà sau phản ứng nó không bị thay đổi cả về lượng và chất.
NH3 là chất đầu quan trọng trong công nghiệp hóa chất, được sản xuất theo phương pháp Haber-Bosch sử dụng trực tiếp giữa H2 và N2:
N2 (khí) + 3H2 (khí) ⇄ 2NH3 (khí) (∆H < 0)
Tại điều kiện tỉ lệ mol giữa N2 và H2 là 1:3, nhiệt độ 450oC, áp suất 200 atm, xúc tác là sắt (Fe) dạng bột mịn, phản ứng tổng hợp NH3 cho hiệu suất khoảng 25%.
Phát biểu nào sau đây KHÔNG ĐÚNG về quá trình tổng hợp NH3?
Phản ứng có ∆H < 0 ⟹ Phản ứng thuận là phản ứng tỏa nhiệt.
⟹ Khi giảm nhiệt độ, cân bằng phản ứng chuyển dịch theo chiều thuận ⟶ làm tăng hiệu suất tổng hợp amoniac ⟹ B sai.
A đúng vì nhiệt độ ảnh hưởng tới tốc độ phản ứng, khi giảm nhiệt độ sẽ làm giảm tốc độ phản ứng.
D đúng vì xúc tác làm tăng tốc độ phản ứng thuận và nghịch.
C đúng vì tổng số mol khí vế trái bằng 4 > tổng số mol khí vế phải bằng 2 ⟶ tăng áp suất làm cân bằng chuyển dịch theo chiều thuận ⟶ làm tăng hiệu suất tổng hợp amoniac.
Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nhiệt độ.
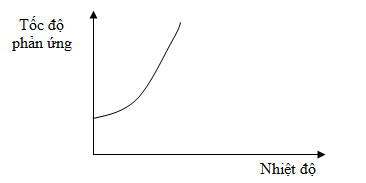
Từ đồ thị trên, ta thấy tốc độ phản ứng:
Theo đồ thị ta thấy khi nhiệt độ tăng, tốc độ phản ứng tăng.
Cho 6 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 4M (dư) ở nhiệt độ thường. Nếu giữ nguyên các điều kiện khác, chỉ thay 6 gam kẽm hạt bằng 6 gam kẽm bột thì tốc độ phản ứng sẽ:
Kẽm ở dạng bột => diện tích bề mặt đã tăng lên so với trước nên tốc độ phản ứng sẽ tăng lên
Một chất xúc tác được gọi là có hiệu quả cao khi làm tăng nhanh tốc độ phản ứng. Người ta thấy hai chất xúc tác Fe2O3 và MnO2 đều có khả năng làm xúc tác cho phản ứng phân huỷ H2O2. Sử dụng hai chất này làm xúc tác cho phản ứng phân huỷ H2O2, kết quả đo nồng độ H2O2 theo thời gian thu được được thể hiện qua đồ thị sau:

Phát biểu nào sau đây không đúng?
Từ đồ thị thấy rằng xúc tác MnO2 có hiệu quả hơn vì khi có mặt xúc tác MnO2 nồng độ H2O2 giảm nhanh hơn => D sai
Cho hai miếng magnesium có kích thước giống nhau. Một miếng là khối magnesium đặc (A), một miếng có nhiều lỗ nhỏ bên trong và trên bề mặt (B). Thả hai miếng magnesium vào hai cốc đựng dung dịch H2SO4 1M có cùng thể tích. Theo dõi thể tích khí thoát ra theo thời gian, kết quả thu được được biểu diễn ở hình dưới đây:
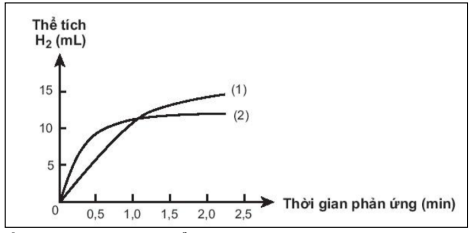
Phát biểu nào sau đây không đúng?
- Vì thanh B có nhiều lỗ nhỏ => Thanh B có tổng diện tích tiếp xúc bề mặt lớn hơn thanh A => Ban đầu tốc độ phản ứng ở thanh B nhanh hơn => Tốc độ thoát khí nhanh hơn.
- Do hai miếng có cùng kích thước, mà thanh B có nhiều lỗ nhỏ => Khối lượng magnesium ở thanh B nhỏ hơn thanh A nên sau một thời gian phản ứng thì lượng magnesium ở thanh B hết => Lượng khí thoát ra không đổi và nhỏ hơn lượng khí thoát ra ở thanh A
=> D sai
Một nhóm học sinh đã thực hiện dự án “khám phá ảnh hưởng của các yếu tố đến tốc độ phản ứng hoá học”, nhóm học sinh sử dụng 4,0 ml dung dịch KMnO4 0,01M và 2,0 ml dung dịch H2C2O4 0,1M cho các thí nghiệm, thay đổi các điều kiện như sau:

Phát biểu nào sau đây không đúng?
Từ bảng số liệu ta thấy:
- thí nghiệm 1 và thí nghiệm 2 khác nhau ở thành phần chất khác => Yếu tố ảnh hưởng là chất xúc tác => B đúng
- thí nghiệm 1 và thí nghiệm 3 khác nhau ở thành phần nhiệt độ => Yếu tố ảnh hưởng là nhiệt độ => A đúng
- thí nghiệm 1 và thí nghiệm 4 khác nhau ở thành phần nồng độ H2SO4 => Yếu tố ảnh hưởng là nồng độ H2SO4 => D sai
- mục đích của việc thêm 1 ml nước cất trong thí nghiệm 4 để nồng độ KMnO4 và H2C2O4 không đổi vì có tổng thể tích dung dịch đều bằng 2 ml => C đúng
Hình dưới đây minh hoạ ảnh hưởng của yếu tố nào đến tốc độ phản ứng?

Hình trên minh hoạ ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng
Cho đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước như sau:
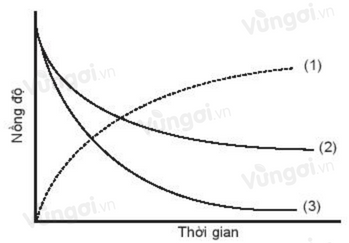
Đường cong nào là của oxygen?
PTHH: \({O_2} + 2{H_2} \to 2{H_2}O\)
Nhận thấy O2 và H2 là các chất tham gia phản ứng nên nồng độ theo thời gian sẽ giảm
Theo PTHH số phân tử O2 tham gia phản ứng ít hơn số phân tử H2 nên số va chạm hiệu quả với H2 để tạo thành H2O ít hơn => Sự giảm nồng độ theo thời gian của O2 chậm hơn so với H2 => Tương ứng với đường cong (2)
Cho phương trình hóa học: A(k) + 2B(k) → AB2 (k)
Tốc độ phản ứng sẽ tăng nếu
Tốc độ phản ứng sẽ tăng nếu
- tăng áp suất
- tăng nhiệt độ
- tăng nồng độ khí A, B
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng sau:
CaCO3 (r) + 2HCl(dd) → CaCl2 + H2O + CO2 ↑
Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Nhiệt độ: nếu nhiệt độ tăng thì tốc độ phản ứng tăng.
+ Chất xúc tác: nếu thêm chất xúc tác thì khí CO2 thoát ra nhanh hơn => Tốc độ phản ứng tăng.
+ Diện tích tiếp xúc: CaCO3 ở dạng hạt nhỏ phản ứng xảy ra nhanh hơn CaCO3 ở dạng khối => Khi tăng diện tích tiếp xúc thì tốc độ phản ứng tăng.
+ Áp suất không ảnh hưởng đến tốc độ phản ứng trên vì phản ứng trên không có chất khí tham gia phản ứng.
Cho phản ứng hóa học sau : 2H2O2 (l) $\xrightarrow{{Mn{O_2}}}$ 2H2O(l) + O2 (k). Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng trên ?
Các yếu tố ảnh hưởng đến tốc độ của phản ứng trên :
- Nồng độ H2O2 : nếu tăng nồng độ H2O2 thì tốc độ phản ứng tăng.
- Thêm chất xúc tác : làm tăng tốc độ của phản ứng.
- Nhiệt độ : nếu tăng nhiệt độ thì tốc độ phản ứng tăng.
→ Yếu tố không ảnh hưởng đến tốc độ của phản ứng là áp suất vì chất tham gia không phải là chất khí.
Nội dung nào thể hiện trong các câu sau đây là sai ?
Nội dung A đúng vì khi đó nhiệt độ giảm nên tốc độ phản ứng phân hủy thực phẩm giảm, thực phẩm giữ được lâu hơn.
Nội dung B đúng vì tăng áp suất tốc độ phản ứng tăng.
Nội dung C đúng vì tăng nồng độ chất phản ứng thì tốc độ phản ứng tăng.
Nội dung D sai vì ở tầng khí quyển trên cao khí oxi loãng hơn so với mặt đất nên nhiên liệu cháy chậm hơn.
Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric:
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
A. Sai vì cả hai nhóm dùng nồng độ HCl như nhau là 2M
B. Đúng
C. Sai, vì kẽm bột là chất rắn nên không có nồng độ
D. Sai
Có hai cốc chứa dung dịch Na2SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí nghiệm trên là
Cốc A có nồng độ lớn hơn cốc B, nên khi cho cùng nồng độ dd H2SO4 vào 2 cốc thì cốc A sẽ có tốc độ phản ứng nhanh hơn cốc B.
→ cốc A xuất hiện kết tủa nhanh hơn cốc B.

