Bài 6: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Sách chân trời sáng tạo
Nguyên tố X có cấu hình e là : 1s22s22p63s23p3. Kết luận không đúng là :
C. Số electron lớp ngoài cùng của X bằng 3 nên X thuộc nhóm III A trong bảng hệ thống tuần hoàn
Sai : số electron lớp ngoài cùng là 5 chứ không phải 3
Cho các nguyên tử X, Y, Z, T thuộc cùng một chu kỳ và thuộc cùng nhóm A trong bảng tuần hoàn hoá học. Bán kính nguyên tử của các nguyên tố được biểu diễn như hình sau:
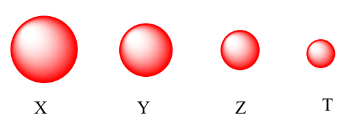
Nguyên tử có độ âm điện nhỏ nhất là
Các nguyên tố có cùng số lớp electron thì được xếp vào cùng một chu kỳ
Trong một chu kỳ theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử càng nhỏ thì độ âm điện càng mạnh
=> Nguyên tử có độ âm điện nhỏ nhất là X
Cho bảng tuần hoàn mô phỏng dưới đây:

Cho các phát biểu sau:
(a) A và D đều có 3 lớp electron.
(b) B, C đều tạo với oxygen hợp chất có dạng X2O.
(c) A có 4 electron lớp ngoài cùng và có 2 lớp electron.
(d) E có 4 electron lớp ngoài cùng và có ba lớp electron.
(e) D và E đều tạo với hydrogen hợp chất có dạng RH.
Số phát biểu đúng là
(a) sai. A nằm ở chu kì 3 có 3 lớp electron. D nằm ở chu kì 2 có 2 lớp electron
(b) đúng vì B và C đều thuộc nhóm IA
(c) sai. A thuộc chu kì 3, nhóm IVA => A có 3 lớp electron và có 4 electron lớp ngoài cùng
(d) sai. A có 3 lớp electron và có 4 electron lớp ngoài cùng
(e) sai. E có 3 lớp electron và 7 electron lớp ngoài cùng
Cho hình vẽ biểu diễn kích thước của các nguyên tử Na, K, F, Cl dưới đây:

Biết số thứ tự của Na, K, F, Cl trong bảng tuần hoàn hoá học lần lượt là 11, 19, 9, 17. Phát biểu nào sau đây đúng?
Cấu hình nguyên tử của
- Na (Z=11): 1s22s22p63s1 => Nhóm IA, chu kì 3
- K (Z=19): 1s22s22p63s23p64s1 => Nhóm IA, chu kì 4
- F (Z=9): 1s22s22p5 => Nhóm VIIA, chu kì 2
- Cl (Z=17): 1s22s22p63s23p5 => Nhóm VIIA, chu kì 3
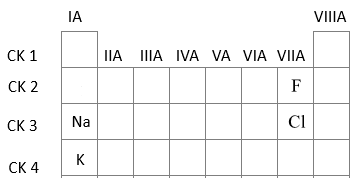
- Trong cùng 1 nhóm A theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử tăng dần
=> \({r_{Na}} < {r_K}\) và \({r_F} < {r_{Cl}}\) (1)
- Trong cùng 1 chu kì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần
=> \({r_{Cl}} < {r_{Na}}\)(2)
Từ (1) và (2) => \({r_F} < {r_{Cl}} < {r_{Na}} < {r_K}\)
=> X là F, Y là Cl, Z là Na và T là K
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn các nguyên tố hoá học. Oxide của X tan trong nước tạo thành một dung dịch làm quỳ tím hoá đỏ. Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh. Oxide của Z phản ứng được với cả acid lẫn kiềm. Dãy các nguyên tố được sắp xếp theo chiều tăng dần số hiệu nguyên tử từ trái sang phải là
- Oxide của X tan trong nước tạo thành dung dịch làm quỳ tím hoá đỏ => Hydroxide của X có tính acid => X là 1 phi kim
- Y phản ứng với nước tạo thành dung dịch làm quỳ tím hoá xanh => Hydroxide của Y có tính base => Y là một kim loại
- Z phản ứng được với cả acid lẫn kiềm và X, Y, Z thuộc cùng 1 chu kì => Tính kim loại giảm dần theo thứ tự Y, Z, X
- Theo bài có X, Y, Z thuộc cùng 1 chu kì. Theo quy luật tuần hoàn, theo chiều tăng dần số hiệu nguyên tử thì tính kim loại tăng dần
=> Thứ tự tăng dần số hiệu nguyên tử là Y, Z, X
Cho mô hình cấu tạo của 4 nguyên tố dưới đây:
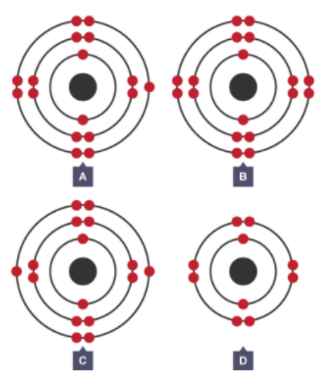
Số nguyên tố phi kim là
A có 7 electron lớp ngoài cùng => A là phi kim
B có 8 electron lớp ngoài cùng => B là khí hiếm
C có 6 electron lớp ngoài cùng => C là phi kim
D có 8 electron lớp ngoài cùng => D là khí hiếm
=> Có 2 nguyên tố phi kim
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp
TH1. pY – pX = 1 (X, Y thuộc chu kì 2, 3)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 17 \hfill \\{p_X} = 16 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^5} \hfill \\X:\,{\text{[}}Ne]3{s^2}3{p^4} \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,\,Cl \hfill \\X:\,\,S \hfill \\ \end{gathered} \right.$
A sai vì đơn chất X là chất rắn ở điều kiện thường
B sai vì trong 1 chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện tăng dần
$ \to $ Độ âm điện của Y lớn hơn độ âm điện của X
C sai vì lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 7 electron
TH2. pY – pX = 11 (X, Y thuộc chu kì 4, 5, 6, 7)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 22 \hfill \\{p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^6}3{d^2}4{s^2} \hfill \\X:\,{\text{[}}Ne]3{s^1} \hfill \\ \end{gathered} \right.$
$ \to $Loại vì X, Y không thuộc cùng một chu kì
Cho các nguyên tố sau: Na (Z=11), Al (Z=13), Cl (Z=17). Phát biểu nào sau đây không đúng?
Na (Z=11): 1s22s22p63s1 => Ô số 11, chu kì 3, nhóm IA
Al (Z=13): 1s22s22p63s23p1 => Ô số 13, chu kì 3, nhóm IIIA
Cl (Z=17): 1s22s22p63s23p5=> Ô số 17, chu kì 3, nhóm VIIA
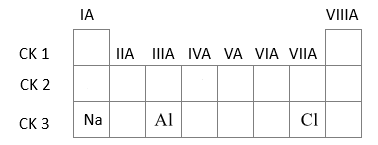
Nhận thấy cả 3 nguyên tố đều cùng thuộc chu kì 3 nhưng khác nhóm
Trong một chu kì theo chiều tăng dần điện tích hạt nhân
- độ âm điện tăng dần => Thứ tự tăng dần về độ âm điện là Na<Al<Cl (A đúng)
- bán kình nguyên tử giảm dần => Thứ tự giảm dần về bán kính nguyên tử là Na>Al>Cl (B đúng)
- tính base của các oxide giảm dần => Thứ tự tăng dần về tính base là Cl2O7<Al2O3<Na2O (C đúng)
- tính acid của hydroxide tăng dần => Thứ tự tăng dần về tính acid là NaOH<Al(OH)3<HClO4 (D sai)
Kí hiệu nguyên tử X là \({}_{16}^{32}X\). Cho các phát biểu sau:
(a) Tổng số hạt mang điện trong X chiếm 66,67% tổng số hạt trong X.
(b) X có số p=số e= số n=16.
(c) X là nguyên tố p.
(d) X có tính phi kim.
(e) X có tính phi kim yếu hơn Y, biết Y có Z=8.
Số phát biểu đúng là
Từ kí hiệu nguyên tử => X có Z = số proton = số electron = 16; A=N+Z => N=32-16=16 (b đúng)
=> Tổng số hạt mang điện là 16+16=32 hạt
=> Số hạt mang điện chiếm \(\dfrac{{32}}{{16 + 16 + 16}}.100\% \simeq 66,67\% \) tổng số hạt trong X (a đúng)
Cấu hình electron của X: 1s22s22p63s23p4 => Ô số 16, chu kì 3, nhóm IVA
=> X là nguyên tố p vì electron cuối cùng được điền vào phân lớp 3p (c đúng)
X là phi kim vì có 6e lớp ngoài cùng (d đúng)
Cấu hình electron của Y: 1s22s22p4 => Ô số 8, chu kì 2, nhóm VIA
Nhận thấy X và Y thuộc cùng nhóm khác chu kì
Theo chiều tăng dần điện tích hạt nhân, ta có thứ tự Y<X
Trong một nhóm A theo chiều tăng dần điện tích hạt nhân, tính phi kim giảm dần => X có tính phi kim yếu hơn Y (e đúng)
=> Cả 5 phát biểu đều đúng
Quá trình sản xuất aluminium từ quặng bauxite gồm tinh chế bauxite và trộn Al2O3 thu được cryolite (Na3AlF6) rồi điện phân nóng chảy. Trường hợp bể điện phân chưa đúng tiêu chuẩn, sản phẩm là Al có lẫn Na. Cho 3,65 gam hỗn hợp sản phẩm phản ứng với dung dịch sulfuric acid loãng, dư thoát ra 4338,25 ml khí hydrogen (25oC và 1 bar). Biết số hiệu nguyên tử của Na và Al lần lượt là 11 và 13. Phát biểu nào sau đây không đúng?
PTHH:
\(\begin{array}{l}Na + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}\\2Al + 3{H_2}S{O_4} \to A{l_2}{(S{O_4})_3} + 3{H_2}\end{array}\)
Gọi số mol của Na và Al lần lượt là a mol và b mol
Dựa vào khối lượng hỗn hợp => 23a + 27b = 3,65 (1)
Dựa vào số mol của khí thoát ra => a + 1,5b = \(\dfrac{{4,33825}}{{24,79}} = 0,175\) (2)
Từ (1) và (2) => a=0,1 mol và b=0,05 mol
=> Độ tinh khiết của aluminium trong sản phẩm là \(\dfrac{{0,05.27}}{{3,65}}.100\% \simeq 37\% \)(C sai)
Na có Z=11: 1s22s22p63s1 => Ô số 11, chu kì 3, nhóm IA
=> Oxide ứng với hóa trị cao nhất của Na là Na2O
Al có Z=13: 1s22s22p63s23p1 => Ô số 13, chu kì 3, nhóm IIIA
=> Oxide ứng với hóa trị cao nhất của Al là Al2O3
- Nhận thấy Na, Al cùng chu kì, khác nhóm
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid của hydroxide tăng dần
=> Thứ tự tính acid tăng dần là NaOH < Al(OH)3 (B đúng)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần
=> Al có tính kim loại yếu hơn Na (D đúng)
Kim loại M thuộc nhóm IIA của bảng tuần hoàn, là một thành phần dinh dưỡng quan trọng. Sự thiếu hụt rất nhỏ của nó đã ảnh hưởng tới sự hình thành và phát triển của xương và răng. Thừa M có thể dẫn đến sỏi thận. Cho 0,8 gam M tác dụng hết với dung dịch HCl, thu được 0,4958 lít khí đo ở 25oC và 1 bar. Cho số hiệu nguyên tử của Ca, K và Mg lần lượt là 20, 19 và 12. Phát biểu nào sau đây không đúng?
PTHH: \(M + 2HCl \to MC{l_2} + {H_2}\)
Từ phương trình => \({n_M} = {n_{{H_2}}} = \dfrac{{0,4958}}{{24,79}} = 0,02\)mol => M=\(\dfrac{{0,8}}{{0,02}} = 40\)=> M là Ca (A đúng)
Ca (Z=20): 1s22s22p63s23p64s2 => Ô số 20, chu kì 4, nhóm IIA
K (Z=19): 1s22s22p63s23p64s1 => Ô số 19, chu kì 4, nhóm IA
Mg (Z=12): 1s22s22p63s2 => Ô số 12, chu kì 3, nhóm IIA
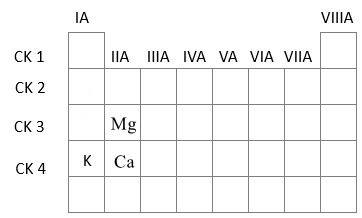
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần => K có tính kim loại mạnh hơn Ca
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần => Ca có tính kim loại mạnh hơn Mg
=> Thứ tự tính kim loại tăng dần là Mg<Ca<K (B đúng)
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần => Ca có độ âm điện lớn hơn K
Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần => Mg có độ âm điện lớn hơn Ca
=> Thứ tự độ âm điện giảm dần là Mg>Ca>K (C sai)
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tính base của hydroxide giảm dần => KOH có tính base mạnh hơn Ca(OH)2 (D đúng)
Cation R3+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Phát biểu nào sau đây không đúng?
Cấu hình electron của R3+: 1s22s22p6
R nhường 3 electron tạo R3+ => Cấu hình electron của R: 1s22s22p63s23p1
Cấu hình electron lớp ngoài cùng của R được biểu diễn dưới dạng orbital là
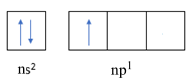
=> R có 1 electron độc thân (A sai)
R ở ô số 13, chu kì 3, nhóm IIIA (D đúng)
=> Oxide ứng với hóa trị cao nhất của R là R2O3 (B đúng)
R là một kim loại vì có 3e ở lớp ngoài cùng (C đúng)
Các nguyên tố X, Y, M, T có số hiệu nguyên tử lần lượt là 6, 9, 14, 17. Phát biểu nào sau đây không đúng?
X (Z=6): 1s22s22p2 => Ô số 6, chu kì 2, nhóm IVA
Y (Z=9): 1s22s22p5=> Ô số 9, chu kì 2, nhóm VIIA
M (Z=14): 1s22s22p63s23p2 => Ô số 14, chu kì 3, nhóm IVA
T (Z=17): 1s22s22p63s23p5 => Ô số 17, chu kì 3, nhóm VIIA
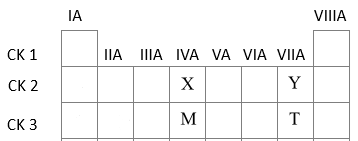
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần => X có tính kim loại mạnh hơn Y
Trong một nhóm theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần => M có tính kim loại mạnh hơn X
=> Thứ tự tính kim loại tăng dần là Y<X<M (A đúng)
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, độ âm điện tăng dần => Y có độ âm điện lớn hơn X (B đúng)
X và T là 2 nguyên tố ở hai chu kì liên tiếp nhưng khác nhóm (C đúng)
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid tăng dần => MO2 có tính acid yếu hơn T2O7 (D sai)
Nguyên tử M có Z=23. Vị trí của M trong bảng tuần hoàn là
M (Z=23): 1s22s22p63s23p63d34s2 => Ô số 23, chu kì 4, nhóm VB
Ion M3+ có phân lớp electron ngoài cùng là 3d5. Ion Y- có cấu hình electron ngoài cùng là 4p6. Phát biểu nào sau đây không đúng?
M3+ có phân lớp electron ngoài cùng là 3d5 => Cấu hình electron của M3+: 1s22s22p63s23p63d54s2
Từ M nhường 3e tạo M3+ => Cấu hình electron của M: 1s22s22p63s23p63d84s2 (D đúng)
=> M ở ô số 28, chu kì 4, nhóm VIIIB (A sai)
Y- có cấu hình electron ngoài cùng là 4p6
=> Cấu hình electron của Y-: 1s22s22p63s23p63d104s24p6
Từ Y nhận 1e tạo Y- => Cấu hình electron của Y: 1s22s22p63s23p63d104s24p5
=> Y ở ô số 35, chu kì 4, nhóm VIIA
B đúng vì electron cuối cùng của Y được điền vào phân lớp 4p
C đúng
Ba nguyên tố với số hiệu nguyên tử Z=11, Z=12, Z=13 có hydroxide tương ứng là X, Y, T. Chiều giảm dần tính acid của các hydroxide này là
Z=11: 1s22s22p63s1 => Ô số 11, chu kì 3, nhóm IA
Z=12: 1s22s22p63s2 => Ô số 12, chu kì 3, nhóm IIA
Z=13: 1s22s22p63s23p1 => Ô số 13, chu kì 3, nhóm IIIA
Nhận thấy cả 3 nguyên tố trên đều cùng thuộc chu kì 3
=> Vị trí các hydroxide X, Y, T tương ứng trong BTH là
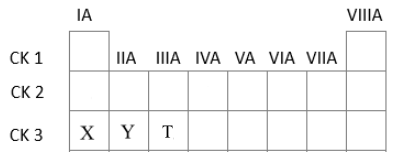
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide tăng dần
=> Thứ tự giảm dần tính acid của các hydroxide là T, Y, X
Cho các nguyên tố sau: 14Si, 15P và 16S
Phát biểu nào sau đây không đúng?
14Si: 1s22s22p63s23p2 => Ô số 14, chu kì 3, nhóm IVA
15P: 1s22s22p63s23p3 => Ô số 15, chu kì 3, nhóm VA
16S: 1s22s22p63s23p4 => Ô số 16, chu kì 3, nhóm VIA
Nhận thấy 3 nguyên tố trên cùng thuộc chu kì 3
A đúng vì electron cuối cùng của cả 3 nguyên tố trên đều điền ở phân lớp p
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính phi kim tăng dần
=> Thứ tự giảm dần tính phi kim là S, P, Si (B đúng)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính base của oxide giảm dần
=> Thứ tự tính base tăng dần là SO3, P2O5, SiO2 (C sai)
- Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid của hydroxide tăng dần
=> Thứ tự tăng dần tính acid của hydroxide là H2SiO3, H3PO4, H2SO4 (D đúng)
Cho cấu hình nguyên tử của X là: 1s22s22p63s23p63d14s2. Vị trí của X trong bảng tuần hoàn là
- Ô 21
- Chu kì 4 vì có 4 lớp electron
- Nhóm B vì electron cuối cùng được điền vào phân lớp 3d. Số thứ tự của nhóm là IIIB
Cho mô hình cấu tạo của một số nguyên tố:
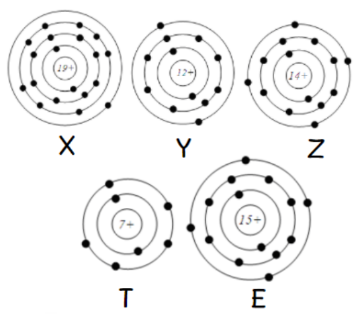
Phát biểu nào sau đây không đúng?
A đúng. Z, E có cùng 4 electron lớp ngoài cùng
B đúng vì Y, Z, E có cùng số lớp electron
C sai. Nguyên tố có 1, 2 hoặc 3 electron lớp ngoài cùng thì là kim loại => Nguyên tố X, Y
D đúng. Nguyên tố có 5, 6 hoặc 7 electron lớp ngoài cùng thì là phi kim => Nguyên tố T
Theo cấu hình electron, nguyên tố hóa học chia thành mấy nguyên tố?
Theo cấu hình electron, nguyên tố hóa học chia thành 4 nguyên tố là nguyên tố s, nguyên tố p, nguyên tố d và nguyên tố f

