Nguyên tử R có điện tích ở lớp vỏ là -41,6.10-19 culong. Điều khẳng định nào sau đây là không chính xác?
Điện tích của 1 electron bằng -1,6.10-19 culong.
Số electron trong lớp vỏ của nguyên tử R là (-41,6.10-19) : (-1,6.10-19)= 26
Số hạt electron bằng số hạt proton. Do đó hạt nhân của R có 26 proton.
Trong nguyên tử R thì số hạt electron bằng số hạt proton. Do đó trong nguyên tử R thì tổng điện tích âm bằng tổng điện tích dương. Do đó nguyên tử R trung hòa về điện.
Vậy các phát biểu A, B và D chính xác.
Còn phát biểu C không chính xác.
Tổng số hạt proton, electron, nơtron trong nguyên tử của nguyên tố X là 10. Xác định số proton trong nguyên tử nguyên tố X?
Vì tổng số hạt proton, electron, nơtron trong nguyên tử của nguyên tố X là 10 nên P + E + N= 10
Suy ra 2P + N =10 → N= 10 -2P (*)
Mặt khác ta có: P ≤ N ≤ 1,5P nên P ≤ 10 -2P ≤ 1,5P → 2,86 ≤ P ≤ 3,33
Vì số proton là số nguyên nên P = 3
Ion X- có 10 electron. Hạt nhân nguyên tử của nguyên tố X có 10 nơtron. Tổng số hạt trong ion X- là:
Ta có: X + 1e →X-
Do đó số hạt electron trong nguyên tử X là 9 electron. Suy ra số hạt proton trong nguyên tử X là 9 hạt proton
→ Số hạt proton trong ion X- là 9 hạt proton.
Vậy tổng số hạt trong ion X- là số p + số n + số e = 9 + 10 + 10= 29 hạt
Trong anion X3- có tổng số hạt là 111, số electron bằng 48% số khối. Nhận xét nào dưới đây về X là đúng?
Gọi số hạt proton, electron, notron trong nguyên tử X lần lượt là P, E và N.
Ta có: X + 3e →X3-
Trong anion X3- có tổng số hạt là 111 nên P + E + N + 3 = 111 → 2P + N= 108 (1)
Vì số electron bằng 48% số khối nên E +3 = 48% (P + N) ↔ P + 3 = 0,48P + 0,48N
↔ 0,52P – 0,48N = -3 (2)
Giải hệ trên ta có P = 33 và N = 42
Số khối của X là A= P + N = 33 + 42= 75. Vậy phát biểu A đúng.
Số electron của X bằng 33. Vậy phát biểu B sai.
Số hạt mang điện trong X bằng P + E = 66. Vậy phát biểu C và phát biểu D sai.
Nguyên tử X có số khối nhỏ hơn 36 và tổng các hạt là 52. Số hạt nơtron trong nguyên tử X là?
Vì nguyên tử X có số khối nhỏ hơn 36 và tổng các hạt là 52 nên ta có:
P + N < 36
P + E + N = 52 → 2P + N = 52 → N= 52 – 2P (1)
Mặt khác ta có P ≤ N ≤ 1,5P nên P ≤ 52 – 2P ≤ 1,5P → 14,86 ≤ P ≤ 17,33
Vì P là số hạt proton nên P là số tự nhiên. Ta xét bảng sau:

Vậy số notron trong nguyên tử X là 18 hạt.
Oxit X có công thức R2O. Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron)?
Gọi số p, n, e trong nguyên tử nguyên tố R lần lượt là P, N, E.
Vì tổng số hạt cơ bản (p, n, e) trong X là 92 nên 2. (P + N + E) + (8+8+8)= 92 → 2P + N= 34 (1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 28 nên 2. (P+E) + (8+8) – 2.N – 8= 28
→4P – 2N= 20 (2)
Giải hệ (1) và (2) ta có P = 11 và N= 12
Suy ra A= P + N= 23. Vậy R là nguyên tố Na. Vậy X là Na2O.
Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 58. Biết số hạt p ít hơn số hạt n là 1 hạt. Kí hiệu của A là
Đặt số p = số e = Z; số n = N
- Tổng hạt: 2Z + N = 58
- Hạt p ít hơn hạt n: N – Z = 1
Giải hệ tìm được Z = 19, N = 20 => A = Z + N = 19 + 20 = 39
Kí hiệu của nguyên tố: \({}_{19}^{39}K\)
Tổng các hạt cơ bản trong một nguyên tử là 82 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số p, n, e lần lượt là
Đặt số p = số e = Z; số n = N
- Tổng hạt: 2Z + N = 82
- Hạt mang điện nhiều hơn hạt không mang điện: 2Z – N = 22
Giải hệ thu được Z = 26 và N = 30
Vậy số p, n, e lần lượt là 26, 30, 26.
Một hợp chất có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim ở chu kì 3. Trong hạt nhân của M có n – p= 4, trong hạt nhân của A có n’= p’. Tổng số proton trong MAx là 58. Xác định nguyên tố, số hạt proton trong nguyên tử M, A và công thức của MAx?
Trong hợp chất MAx thì M chiếm 46,67% về khối lượng nên ta có:
\({M \over {xA}} = {{46,67} \over {53,33}} \to {{n + p} \over {x(n' + p')}} = {7 \over 8}(1)\)
Thay n – p = 4 và n’ = p’ vào (1) ta có: \({{2p + 4} \over {2xp'}} = {7 \over 8}\)
Tổng số proton trong MAx là 58 nên p +xp’= 58 (2)
Giải (1) và (2) ta có p= 26 và xp’ = 32
Do A là phi kim ở chu kì 3 nên 15 ≤ p’≤17.
Vậy x=2 và p’=16 thỏa mãn
Vậy M là Fe và A là S. Công thức phân tử FeS2.
Cho nguyên tử nguyên tố R có 82 hạt . Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Số khối của nguyên tử R là?
Đặt số p = số e = Z; số n = N
- Tổng hạt: 2Z + N = 82 (1)
- Số hạt mang điện nhiều hơn số hạt không mang điện: 2Z – N = 22 (2)
Giải (1) và (2) => Z = 26 và N = 30
=>Số khối A = Z + N = 26 + 30 = 56
Tổng số hạt mang điện trong nguyên tử X là 112. Số proton trong X là
Trong nguyên tử, các loại hạt mang điện là hạt p và hạt e.
Số p = Số e = Z => Tổng hạt mang điện là: 2Z = 112 => Z = 56
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là:
Gọi số hạt proton (bằng số hạt electron) trong nguyên tử là Z, số hạt notron trong nguyên tử là N
Ta có: Nguyên tử của nguyên tố X có tổng số hạt là 40 suy ra 2Z + N= 40
Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt nên 2Z – N= 12
Giải hệ trên ta có: Z= 13 và N= 14
Vậy số khối của X là A= Z + N= 13 + 14= 27.
Một nguyên tử X có tổng số các loại hạt là 40. Số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số khối X là
Đặt số p = số e = Z, số n = N
- Tổng số hạt là 40: 2Z + N = 40 (1)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 12: 2Z – N = 12 (2)
Giải (1) và (2) thu được Z = 13 và n = 14
Số khối: A = Z + N = 13 + 14 = 27
Nguyên tử R có tổng số hạt p, n, e là 13. Số khối của nguyên tử R là:
Trong 82 nguyên tố đầu tiên ta luôn có:
1 ≤ N/Z ≤ 1,5
Mà N = 13 – 2Z => 1 ≤ (13 – 2Z)/Z ≤ 1,5
=> 3,71 ≤ Z ≤ 4,33
=> Z = 4
=> N = 5
=> A = Z + N = 9
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt, số khối của X là 23. Số notron của X là:
X có : p + n + e = 2p + n = 34 ; ZX = p + n = 23
=> n = 12
=>B
Tổng số hạt cơ bản trong một nguyên tử là 82 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của nguyên tử đó là:
Ta có hệ : 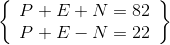 => P + E = 52 : N = 30
=> P + E = 52 : N = 30
Mà P = E => P = E = 52 : 2 = 26
=>A = 26 + 30 = 56
Nguyên tố Y có khả năng tạo thành ion Y2+. Trong cation Y2+, tổng số hạt cơ bản là 34 hạt, trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Số hiệu nguyên tử của Y là:
Y2+ có : số hạt mang điện là [p + (e – 2)]
=> [p + (e – 2)] – n = 10
=> 2p – n = 12
Y2+ có 34 hạt cơ bản => Y có 34 + 2 = 36 hạt cơ bản
=> p + e + n = 2p + n = 36
=> p = 12 ( p là số hiệu nguyên tử của Y)
=>B
Một nguyên tố R có 3 đồng vị X, Y, Z; biết tổng số các hạt cơ bản (n, p , e) trong 3 đồng vị bằng 129, số notron đồng vị X hơn đồng vị Y một hạt. Đồng vị Z có số proton bằng số notron. Số khối của X, Y, Z lần lượt là:
Giả sử số hạt notron trong X, Y, Z lần lượt là NX, NY, NZ
Vì X, Y, Z là đồng vị nên chúng đều có số p= số e = Z
Ta có hệ phương trình:
\(\left\{ \matrix{(2Z + {N_x}) + (2Z + {N_Y}) + (2Z + {N_Z}) = 129 \hfill \cr {N_X} - {N_Y} = 1 \hfill \cr Z = {N_Z} \hfill \cr} \right.\)
Suy ra 7Z + NY = 128
Mà Z ≤ N ≤ 1,5Z
Suy ra Z ≤ 14,22 và Z ≥ 12,8
Mà Z là số nguyên nên Z = 13 và Z = 14
-Xét trường hợp 1: Z= 13
Suy ra NZ= 13, NX= 19,5, NY= 18,5 → Loại
-Xét trường hợp 2: Z= 14
Suy ra NZ= 14, NX= 16, NY= 15
→ Số khối của X, Y, Z lần lượt là 30, 29, 18
Nguyên tử X có tổng số hạt là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Khẳng định nào sau đây là đúng?
Gọi số hạt trong X là: p, n, e. Ta có hệ phương trình
\(\left\{ \matrix{
{\rm{2p + n = 40}} \hfill \cr
{\rm{2p - n = 12}} \hfill \cr} \right. \to \left\{ \matrix{
{\rm{p = 13}} \hfill \cr
{\rm{n = 14}} \hfill \cr} \right.\)
X (Z = 13): 1s22s22p63s23p1
Điện tích hạt nhân của X: +13.1,602.10-19 = .+ 2,0826.10-18 C → B đúng
X là kim loại do có 3e ở lớp ngoài cùng → A sai
X là nguyên tố p do electron cuối cùng điền vào phân lớp p, X có 7 electron p → C,D sai
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
X có 7 electron p → X: 1s22s22p63s23p1 → X có số p = 13
Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên:
2py = 13.2 + 8 → py = 17
→ Y: 1s22s22p63s23p5

