Tính thể tích khí bay ra ở đktc trong TN1?
TN1: Đặt ${{n}_{HCl}}=x\Rightarrow \text{ }{{n}_{{{H}_{2}}}}=\frac{x}{2}$
Bảo toàn khối lượng: mKL + mHCl = mrắn + mH2
=> 2,02 + 36,5x = 4,86 + 2x/2
=> x = 0,08
=> V = 22,4.x/2 = 0,896 lít
Tính khối lượng mỗi kim loại trong 10,1 gam hỗn hợp A?
TN1: A + 200 ml HCl → 4,86 gam rắn
TN2: A + 400 ml HCl → 5,57 gam rắn
Nhận xét: Lượng HCl tăng gấp đôi nhưng lượng chất rắn tăng chậm hơn => TN2 có HCl dư, kim loại tan hết
Đặt a, b là số mol Mg, Zn trong 2,02 gam A
=> mA = 24a + 65b = 2,02
mmuối = 95a + 136b = 5,57
=> a = 0,03 và b = 0,02
=> mMg = 0,72 gam và mZn = 1,3 gam
=> trong 10,1 gam A chứa 3,6 gam Mg và 6,5 gam Zn
Tính khối lượng mỗi kim loại trong 10,1 gam hỗn hợp A?
TN1: A + 200 ml HCl → 4,86 gam rắn
TN2: A + 400 ml HCl → 5,57 gam rắn
Nhận xét: Lượng HCl tăng gấp đôi nhưng lượng chất rắn tăng chậm hơn => TN2 có HCl dư, kim loại tan hết
Đặt a, b là số mol Mg, Zn trong 2,02 gam A
=> mA = 24a + 65b = 2,02
mmuối = 95a + 136b = 5,57
=> a = 0,03 và b = 0,02
=> mMg = 0,72 gam và mZn = 1,3 gam
=> trong 10,1 gam A chứa 3,6 gam Mg và 6,5 gam Zn
Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dung dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước).
${{n}_{{{H}_{2}}}}=\frac{1}{22,4}=0,0446\,mol;\,\,{{n}_{C{{l}_{2}}}}=0,03\,mol$
H2 + Cl2 → 2HCl (1)
Vì ${{n}_{{{H}_{2}}}}>{{n}_{C{{l}_{2}}}}$ => hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl + HNO3
=> nHCl (trong 5g A) = nAgCl = 0,01 mol
=> nHCl (trong 20g A) = 0,01.4 = 0,04 mol
(1) => nCl2 phản ứng = 0,5.nHCl = 0,5.0,04 = 0,02 mol
=> H% = 0,02 / 0,03 .100% = 66,67%
Cho dung dịch chứa 6,09 gam hỗn hợp gồm 2 muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở 2 chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 dư, thu được 10,34 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là:
+) TH1 : Nếu hỗn hợp đầu là NaF và NaCl
=> kết tủa chỉ có AgCl (vì AgF tan) => nAgCl = $\frac{517}{7175}$ mol = nNaCl
=> ${{m}_{NaF}}=6,09\text{ }-\frac{517}{7175}.58,5=1,875$(gam)
=> %mNaF = 30,79% (không có đáp án thỏa mãn)
Đặt số mol của AgNO3 là a => số mol của NaNO3 cũng là a
BTKL : mNaZ + mAgNO3 = mAgZ + mNaNO3
=> 6,09 + a . 170 = 10,34 + a . 85
=> a = 0,05 = nNaZ
=> MNaZ = 6,09 : 0,05 = 121,8
=> MZ = 98,8
=> MX < MZ < MY mà X và Y là kế tiếp nhau nên X là Br (80) , Y là Iot (127)
Ta có hệ : $\left\{ \begin{array}{l}{n_{NaI}}\; + {\rm{ }}{n_{NaBr}} = {\rm{ }}0,05\\{n_{NaI}}.150\; + {\rm{ }}{n_{NaBr}}.103 = {\rm{ 6,09}}\end{array} \right.$
=> nNaI = 0,02 mol và nNaBr = 0,03 mol
=> mNaBr = 0,03 . 103 = 3,09
=> $\%m=\frac{3,09~}{6,09}.100\text{ }\%=50,74\%$
Hòa tan m gam hỗn hợp X gồm MgCl2 và FeCl3 vào nước thu được dung dịch Y. Cho dung dịch Y tác dụng với dung dịch NaOH dư thu được m1 gam kết tủa. Cho dung dịch Y tác dụng với dung dịch AgNO3 thu được m2 gam kết tủa. Biết m2 – m1 = 66,7 và tổng số mol muối trong hỗn hợp X là 0,25 mol. Phần trăm khối lượng MgCl2 trong hỗn hợp X là
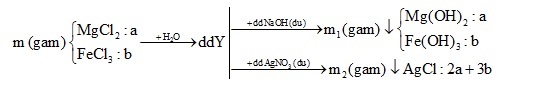
$\Rightarrow \%{{m}_{MgC{{l}_{2}}}}=\frac{0,15.95}{0,15.95+0,1.162,5}.100\%=46,72\%$
Cho m gam hỗn hợp KClO, KClO2, KClO3 tác dụng với dung dịch HCl đặc, dư thu được dung dịch chứa 13,41 gam KCl và 8,064 lít khí Cl2 (đktc). Giá trị của m là
Quy đổi hỗn hợp ban đầu về KCl và O
BT nguyên tố K:
nKCl trước = nKCl sau= 0,18 mol
\(\left\{ \begin{array}{l}KCl\\KCl{O_2}\\KCl{O_3}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}KCl = 0,18mol\\O = xmol\end{array} \right.\)
$\xrightarrow{HCl}$ \(\left\{ \begin{array}{l}KCl = 0,18mol\\C{l_2} = 0,36mol\\{O^{2 - }}\end{array} \right.\)
Bảo toàn e cho nguyên tố oxi và Cl trong axit
2Cl- - 2e → Cl2
0,72\( \leftarrow \) 0,36
O0 + 2e → Cl2
0,72 → 0,36
=> nO = 0,36
=> m = mKCl + mO =13,41+0,36*16= 19,17 (gam)
Hỗn hợp A gồm KClO3, Ca(ClO3)2, Ca(ClO2)2, CaCl2 và KCl nặng 83,68 gam. Nhiệt phân hoàn toàn A thu được chất rắn B gồm CaCl2, KCl và một thể tích O2 vừa đủ để oxi hoá SO2 thành SO3 để điều chế 191,1 gam dung dịch H2SO4 80%. Cho chất rắn B tác dụng với 360 ml dung dịch K2CO3 0,5M (vừa đủ) thu được kết tủa C và dung dịch D. Lượng KCl trong dung dịch D nhiều gấp 22/3 lần lượng KCl có trong A. Phần trăm khối lượng của KClO3 trong hỗn hợp ban đầu là
KClO3 → KCl + 3/2 O2
Ca(ClO2)2 → CaCl2 + 2O2
Ca(ClO3)2 → CaCl2 + 3O2
CaCl2 → CaCl2
KCl →KCl
Chất rắn B là KCl và CaCl2
\(\begin{array}{l}{n_{{H_2}S{O_4}}} = 1,56{\rm{ }}mol{\rm{ }} \Rightarrow {n_{S{O_2}}} = {n_{S{O_3}}} = {n_{{H_2}S{O_4}}} = 1,56{\rm{ }}mol\\\Rightarrow {\rm{ }}{n_{{O_2}}} = 0,78{\rm{ }}mol\end{array}\)
Bảo toàn khối lượng ta có: ${{m}_{A}}={{m}_{B}}+{{m}_{{{O}_{2}}}}\Rightarrow {{m}_{B}}=58,72\text{ }gam$
CaCl2 + K2CO3 → CaCO3 + 2KCl
0,18 ← 0,18 → 0,36
Xét hỗn hợp B ta có: ${{m}_{KCl}}={{m}_{B}}-{{m}_{CaC{{l}_{2}}}}=38,74\text{ }gam$
Vậy khối lượng KCl ở D là: mKCl = 38,74 + 0,36.74,5 = 65,56 gam
m KCl tại A = 3/22 .m KCl trong dung dịch D
=> mKCl tại A = 8,94 gam
Vậy khối lượng KCl tại phản ứng 1 là: 38,74 – 8,94 = 29,8 gam
Theo phản ứng 1 thì: mKClO3 = 49 gam => %KClO3 = 58,55%
Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là
${{n}_{F\text{e}C{{l}_{2}}}}=0,06\,mol;\,{{n}_{F\text{e}C{{l}_{3}}}}=x\,mol$
Bảo toàn nguyên tố Cl: ${{n}_{HCl}}=2.{{n}_{F\text{e}C{{l}_{2}}}}+3.{{n}_{F\text{eC}{{\text{l}}_{3}}}}=~3x+0,12$
Bảo toàn nguyên tố H: ${{n}_{{{H}_{2}}O}}=\frac{1}{2}.{{n}_{HCl}}=\frac{1}{2}.(3x+0,12)=1,5x+0,06$
=> nO = 1,5x + 0,06
Bảo toàn nguyên tố Fe: ${{n}_{F\text{e}\,(trong\,oxit)}}={{n}_{F\text{e}C{{l}_{2}}}}+{{n}_{F\text{e}C{{l}_{3}}}}=0,06+x$
Bảo toàn khối lượng: 9,12 = 56.(x + 0,06) + 16.(1,5x + 0,06)
=> x = 0,06 => ${{m}_{FeC{{l}_{3}}}}=9,75\text{ }gam$
Một hỗn hợp gồm 3 muối NaF, NaCl, NaBr nặng 4,82 gam. Hoà tan hoàn toàn trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy 1/2 lượng muối khan này hoà tan vào nước rồi cho sản phẩm phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Phần trăm khối lượng NaF ban đầu là
Sục Cl2 vào dung dịch A thu được 3,93 gam muối
Thay 1 mol NaBr bằng 1 mol NaCl ---------> khối lượng giảm 44,5 gam
Thay x mol NaBr bằng x mol NaCl ---------> giảm 4,82 – 3,93 = 0,89 gam
=> ${{n}_{NaBr}}=\frac{{{m}_{giam}}}{{{M}_{Br}}-{{M}_{Cl}}}=\frac{0,89}{80-35,5}=0,02\text{ }mol$
=> nNaBr ban đầu = 0,02 mol và nNaCl sinh ra = 0,02 mol
Gọi hh muối khan sau phản ứng với Cl2 là hh B. B gồm NaCl và NaF
Khi cho hh B vào AgNO3 thì AgF không kết tủa
Xét trong 2 phần: ${{n}_{AgCl}}=2.\frac{4,305}{143,5}=0,06\,mol$
=> ∑nNaCl = nAgCl = 0,06 mol => nNaCl ban đầu = 0,06 – 0,02 = 0,04 mol
=> mNaF = 4,82 – 0,02.103 – 0,04.58,5 = 0,42 gam => $\%{{m}_{NaF}}=\frac{0,42}{4,82}.100\%=8,71\%$
Gây nổ hỗn hợp gồm 3 khí trong bình kín. Một khí được điều chế bằng cách cho HCl dư tác dụng với 307,68 gam Mg. Khí thứ 2 điều chế được khi phân hủy hoàn toàn 514,5 gam KClO3 có MnO2 xúc tác. Khí thứ 3 thu được do HCl dư tác dụng với 19,14 gam MnO2. Tính C% của chất trong dung dịch sau khi nổ.
Mg + 2HCl → MgCl2 + H2
12,82 mol → 12,82 mol
2KClO3 → 2KCl + 3O2
4,2 mol → 6,3 mol
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
0,22 → 0,22 → 0,44
2H2 + O2 → 2H2O
12,6 ← 6,3 → 12,6
H2 + Cl2 → 2HCl
0,22 → 0,22 → 0,44
=> chất tan sau phản ứng nổ là HCl (0,44 mol)
mdd sau pứ = mH2O + mHCl = 12,6.18 + 0,44.36,5 = 242,86 gam
=> $C{{\%}_{HCl}}=\frac{0,44.36,5}{242,86}.100\%=6,61\%$
Cho 50 gam dung dịch X chứa 1 muối halogen kim loại hoá trị II tác dụng với dung dịch AgNO3 dư thì thu được 9,4 gam kết tủa. Mặt khác, dùng 150 gam dung dịch X trên phản ứng với dung dịch Na2CO3 dư thì thu được 6,3 gam kết tủa. Lọc kết tủa đem nung đến khối lượng không đổi, khí thoát ra cho vào 80 gam dung dịch KOH 14,5%. Sau phản ứng nồng độ dung dịch KOH giảm còn 3,8%. C% muối trong dung dịch X ban đầu là
Gọi công thức của muối của kim loại hóa trị 2 là AM2
AM2 + 2AgNO3 → 2AgM↓ + A(NO3)2 (1)
Kết tủa thu được chỉ có thể là AgM
Khi cho 150 gam dd X tác dụng với Na2CO3 thì
AM2 + Na2CO3 → ACO3 + 2NaM (2)
Kết tủa thu được là ACO3
ACO3 → AO + CO2 (3)
Khi cho CO2 vào dd KOH dư thì: CO2 + 2KOH → K2CO3 + H2O (4)
Gọi số mol của AM2 trong 50 gam dd X là x mol (x > 0)
=> số mol của AM2 trong 150 gam dd X là 3x mol
Theo PT (2), (3) ta có : ${{n}_{C{{O}_{2}}}}={{n}_{AC{{\text{O}}_{3}}}}={{n}_{A{{M}_{2}}}}=3x~$ (mol)
Ta có : mKOH = 11,6 gam
Theo PT (4): mKOH pứ = 2.nCO2.MKOH = 2.3x.56 = 336x (gam)
=> mKOH dư = 11,6 - 336x (gam)
Khối lượng dd lúc sau là : mdd sau pứ = mCO2 + mdd KOH = 80 + 44.3x = 80 + 132x (g)
C%dd KOH sau pứ = 3,8% => $\frac{11,6-336x}{80+132x}.100\%=3,8\%$
=> x = 0,025mol
Trường hợp lấy 50 gam dd X : mAgM = 9,4 gam, ta có : ${{n}_{AgM}}=2.{{n}_{A{{M}_{2}}}}=0,05\text{ }mol$
=> MAgM = 188 gam => M là Br
Trường hợp lấy 150 gam dd X: ${{m}_{AC{{O}_{3}}}}=6,3\text{ }gam$ và ${{n}_{AC{{O}_{3}}}}={{n}_{A{{M}_{2}}}}=0,075\text{ }mol$
=> A = 24 => A là Mg
=> Công thức của muối là MgBr2
=> trong 50 gam dd X ban đầu chứa 0,025 mol MgBr2
=> $C\%=\frac{0,025.184}{50}.100\%=9,2\%$
Hỗn hợp A gồm hai kim loại Mg và Zn, dung dịch B là dung dịch HCl nồng độ C M. Người ta thực hiện 2 thí nghiệm sau:
TN1: Cho 2,02 gam A vào cốc đựng 200 ml dung dịch B, sau phản ứng đun nóng cho nước bay hơi hết thu được 4,86 gam chất rắn.
TN2: Cho 2,02 gam A vào cốc đựng 400 ml dung dịch B, sau phản ứng đun nóng cho nước bay hơi hết thu được 5,57 gam chất rắn.
Tính khối lượng mỗi kim loại trong 10,1 gam hỗn hợp A?
TN1: A + 200 ml HCl → 4,86 gam rắn
TN2: A + 400 ml HCl → 5,57 gam rắn
Nhận xét: Lượng HCl tăng gấp đôi nhưng lượng chất rắn tăng chậm hơn => TN2 có HCl dư, kim loại tan hết
Đặt a, b là số mol Mg, Zn trong 2,02 gam A
=> mA = 24a + 65b = 2,02
mmuối = 95a + 136b = 5,57
=> a = 0,03 và b = 0,02
=> mMg = 0,72 gam và mZn = 1,3 gam
=> trong 10,1 gam A chứa 3,6 gam Mg và 6,5 gam Zn
Hỗn hợp A gồm hai kim loại Mg và Zn, dung dịch B là dung dịch HCl nồng độ C M. Người ta thực hiện 2 thí nghiệm sau:
TN1: Cho 2,02 gam A vào cốc đựng 200 ml dung dịch B, sau phản ứng đun nóng cho nước bay hơi hết thu được 4,86 gam chất rắn.
TN2: Cho 2,02 gam A vào cốc đựng 400 ml dung dịch B, sau phản ứng đun nóng cho nước bay hơi hết thu được 5,57 gam chất rắn.
Tính thể tích khí bay ra ở đktc trong TN1?
TN1: Đặt ${{n}_{HCl}}=x\Rightarrow \text{ }{{n}_{{{H}_{2}}}}=\frac{x}{2}$
Bảo toàn khối lượng: mKL + mHCl = mrắn + mH2
=> 2,02 + 36,5x = 4,86 + 2x/2
=> x = 0,08
=> V = 22,4.x/2 = 0,896 lít
Cho m gam KMnO4 tác dụng với dung dịch HCl đặc dư thu được dung dịch X chứa HCl dư và 28,07 gam hai muối và V lít khí Cl2 (đktc). Lượng khí Cl2 sinh ra oxi hóa vừa đủ 7,5 gam hỗn hợp gồm Al và kim loại M có có tỉ lệ mol Al : M = 1: 2. Kim loại M là
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Theo PTHH : nKCl = nMnCl2 = x
Khối lượng muối = 28,07 => mKCl + mMnCl2 = 28,07
=> x . 74,5 + x . 126 = 28,07
=> x = 0,14 mol
=> n KCl = n MnCl2 = 0,14 mol
Theo PTHH => ${{n}_{C{{l}_{2}}}}=\frac{5}{2}{{n}_{KCl}}=\frac{5}{2}.0,14=0,35\text{ }mol$
Theo định luật bảo toàn e : $x.{{n}_{M}}+3.{{n}_{Al}}=2.{{n}_{C{{l}_{2}}}}=0,7\text{ }mol$
Có tỉ lệ mol Al : M = 1 : 2 = > nAl = a thì nM = 2a
=> 2a.x + a.3 = 0,7 mol
Với x = 1 => a = 0,175 mol => m Al = 0,175.27 = 4,725 gam
=> mM = 7,5 – 4,725 = 2,775 gam
=> ${{M}_{M}}=\frac{2,775}{0,175.2}=7,9$ (loại)
Với x = 2 => a = 0,1 mol => mAl = 27.0,1 = 2,7 gam => m M = 7,5 – 2,7 = 4,8 gam
$=>~{{M}_{M}}=\frac{4,8}{0,1.2}=24$ (Mg, chọn )
Vậy kim loại cần tìm là Mg
Hỗn hợp X gồm NaBr và NaI. Cho hỗn hợp X tan trong nước thu được dung dịch A. Nếu cho brom dư vào dung dịch A, sau phản ứng hoàn toàn, cô cạn thấy khối lượng muối khan thu được giảm 7,05 gam. Nếu sục khí clo dư vào dung dịch A, phản ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Thành phần % khối lượng của một chất trong hỗn hợp X là:
Gọi số mol NaBr và NaI trong X lần lượt là x và y
- Khi A phản ứng với Br2 :
2NaI + Br2 → 2NaBr + I2
=> mmuối giảm = 127y – 80y = 7,05 => y = 0,15 mol
- Khi A phản ứng với Cl2 :
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
=> mgiảm = (80x + 127y) – 35,5(x + y) = 22,625
=> x = 0,2 mol
Vậy %mNaBr = 47,8% và %mNaI = 52,2%

