Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào:
Các nguyên tố hóa học được sắp xếp vào bảng tuần hoàn theo các nguyên tắc sau:
- Theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố có cùng số electron hoá trị trong nguyên tử xếp thành 1 cột.
- Các nguyên tố có cùng số lớp electron nguyên tử được xếp thành 1 hàng.
Các nguyên tố xếp chu kỳ 6 có số lớp electron trong nguyên tử là:
Những nguyên tố thuộc chu kì 6 có 6 lớp electron.
Trong bảng tuần hoàn các nguyên tố , số chu kỳ nhỏ và số chu kỳ lớn là:
Trong bảng tuần hoàn các nguyên tố hóa học, số chu kì lớn: 4, số chu kì nhỏ: 3.
Nguyên tố hóa học ở vị trí nào trong bảng tuần hoàn có các electron hóa trị là 3d34s2?
Nguyên tố có 4 lớp e => chu kì 4
Nguyên tố có e cuối cùng được điền vào phân lớp d => thuộc nhóm B
Nguyên tố có 5e lớp ngoài cùng => nhóm VB
Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là
Số thứ tự chu kì = số lớp electron => X có 3 lớp electron
Vị trí của flo (Z = 9) trong bảng tuần hoàn là
1. Cấu hình e của nguyên tử là: 1s22s22p5
2. Vị trí của nguyên tố:
- Ô số 9
- Chu kì 2 (vì có 2 lớp e)
- Nhóm VIIA (vì có 7e lớp ngoài cùng)
Nguyên tố X nằm chu kì 3, nhóm VIA. X thuộc loại nguyên tố nào sau đây:
X thuộc chu kì 3 => có 3 lớp e
X thuộc nhóm VIA => có 6e lớp ngoài cùng
=> Cấu hình e của X là: 1s22s22p63s23p4
Ta thấy e cuối cùng được điền vào phân lớp p nên X là nguyên tố p.
Ion R+ có cấu hình electron phân lớp ngoài cùng là 3p6. Vị trí của nguyên tố R trong bảng tuần hoàn là?
- Cấu hình e của ion R+: 1s22s22p63s23p6
- Viết cấu hình e của R: 1s22s22p63s23p64s1
- Xác định vị trí của R dựa vào cấu hình e:
+ Số thứ tự chu kì = số lớp e => Chu kì 4
+ Số thứ tự nhóm A = số e lớp ngoài cùng => Nhóm IA
Số thứ tự của nguyên tố clo là 17, clo thuộc
Cl ( 17 ) : 1s22s22p63s23p5 :
Số e lớp ngoài cùng = 2 + 5 = 7 => nhóm 7 , kết thúc ở phân lớp P => VII A
Có 3 lớp e => chu kì 3
Cho các nguyên tố X1, X2, X3, X4, X5, X6 lần lượt có cấu hình electron như sau:
X1: 1s22s22p63s2 X2: 1s22s22p63s23p64s1
X3: 1s22s22p63s23p64s2 X4 : 1s22s22p63s23p5
X5 : 1s22s22p63s23p6 3d64s2 X6 : 1s22s22p63s23p1
Các nguyên tố thuộc cùng một chu kì là:
X1: 1s22s22p63s2 , X4 : 1s22s22p63s23p5 , X6 : 1s22s22p63s23p1
Cùng có 3 lớp e => nên cùng thuộc chu kì 3
X2: 1s22s22p63s23p64s1, X3: 1s22s22p63s23p64s2 , X5 : 1s22s22p63s23p6 3d64s2
Cùng có 4 lớp e => nên cùng thuộc chu kì 4
Ion Y2+ có cấu hình electron: 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn là
Y2+ có cấu hình electron: 1s22s22p63s23p6 => Cấu hình e của Y: 1s22s22p63s23p64s2
=> Y ở chu kì 4, nhóm IIA
Nguyên tố nào sau đây là nguyên tố s ?
Nguyên tố s là những nguyên tố có e cuối cùng được điền vào phân lớp s
Nguyên tử X có cấu hình electron ở lớp ngoài cùng là 4s24p3. Vị trí của X trong bảng tuần hoàn là
X có cấu hình e là 4s24p3
- 4 lớp e => chu kì 4
- 5e lớp ngoài cùng => nhóm VA
Số nguyên tố thuộc chu kì 3 của bảng tuần hoàn là
Chu kì 3 là chu kì nhỏ nên có 8 nguyên tố
Nguyên tố X nằm ở chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây?
Chu kì 3 => có 3 lớp e
Nhóm VIA => có 6e lớp ngoài cùng
Cấu hình e của X là 1s22s22p63s23p4
Electron cuối cùng được điền vào phân lớp p nên X là nguyên tố p
Cation R+ có cấu tạo như hình. Vị trí của R trong bảng tuần hoàn là
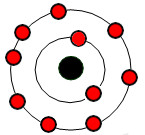
Ta thấy R+ có 10e => R có 11e
Cấu hình e của R là: 1s22s22p63s1
=> R ở chu kì 3, nhóm IA
Các nguyên tố nhóm A trong bảng tuần hoàn gồm:
Nhóm A: bao gồm các nguyên tố s và p.
Các nguyên tố hóa học trong cùng một nhóm A có đặc điểm nào chung về cấu hình e nguyên tử?
Các nguyên tố nhóm A có cấu hình electron là: nsanpb
=> Các nguyên tố thuộc cùng một nhóm A:
+ Có cùng số e lớp ngoài cùng.
+ Khác: số lớp e, phân lớp e và số e ở lớp L.
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là :
BTH các nguyên tố hóa học gồm 3 chu kì nhỏ và 4 chu kì lớn.
Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
Chu kì 3 => có 3 lớp e

