Dung dịch nào sau đây phản ứng với dung dịch HCl dư tạo ra chất khí ?
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Hòa tan hoàn toàn 2,4g Mg vào dung dịch HCl 0,4M. Thể tích dung dịch HCl tối thiểu cần dùng là (Mg=24)
nMg = 2,4 : 24 = 0,1 mol
PTHH: Mg + 2HCl → MgCl2 + H2
0,1 → 0,2 mol
=> nHCl = 0,2 mol => V dd = n : CM = 0,2 : 0,4 = 0,5 (lít) = 500 ml
Cho 19,4 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl (dư). Sau khi phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí H2 (đktc) và m gam kim loại không tan. Giá trị của m là
nH2(đktc) = 4,48 :22,4 = 0,2 (mol)
Khi cho Zn và Cu vào dd HCl chỉ có Zn tham gia phản ứng
Zn + 2HCl → ZnCl2 + H2↑
0,2 ← 0,2 (mol)
→ mZn = 0,2.65 = 13 (g)
→ mCu = 19,4 - mZn = 6,4 (g)
Hòa tan 7,8 gam hỗn hợp bột Al và Mg trong dd HCl dư . Sau phản ứng khối lượng dung dịch tăng thêm 7g so với ban đầu. Khối lượng Al và Mg lần lượt là
Đặt nAl = x mol và nMg = y mol
Có Al → Al +3 + 3e
Mg → Mg+2 + 2e
2H+1 + 2e → H2
Theo bảo toàn e có : 3x + 2y = 2nH2
Bảo toàn KL có mdd tăng = mKL – mH2 = 7 → mH2 = 7,8 – 7 = 0,8 → nH2 = 0,4 mol
Ta có hệ phương trình sau
\(\left\{ \begin{gathered} 3x + 2y = 0,4.2 \hfill \\ 27x + 24y = 7,8 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} x = 0,2 \hfill \\ y = 0,1 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} {m_{Al}} = 5,4 \hfill \\ {m_{Mg}} = 2,4 \hfill \\ \end{gathered} \right.\)
Đun nóng 48,2 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gia thu được 43,4 gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, sau phản ứng thu được 15,12 lít Cl2(đktc) và dung dịch gồm MnCl2, KCl và HCl dư.Số mol HCl phản ứng là
\(X\left\{ \matrix{
K\mathop {Mn}\limits^{ + 7} {O_4} \hfill \cr
K\mathop {Cl}\limits^{ + 5} {O_3} \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow \left\{ \matrix{
Y:{K_2}Mn{O_4},Mn{O_2},KCl,KMn{O_4}du,KCl{O_3}du\buildrel { + H\mathop {Cl}\limits^{ - 1} } \over
\longrightarrow \left\{ \matrix{
\mathop {Mn}\limits^{ + 2} \mathop {C{l_2}}\limits^{ - 1} ,K\mathop {Cl}\limits^{ - 1} ,HCldu \hfill \cr
\mathop {C{l_2}}\limits^0 :0,675\,mol \hfill \cr} \right. \hfill \cr
\mathop {{O_2}:}\limits^0 0,15\,mol \hfill \cr} \right.\)
BTKL ta có:
mO2 = mX – mY = 48,2 -43,4 = 4,8 (g) => nO2= 0,15(mol)
Trong X đặt số mol KMnO4 và KClO3 lần lượt là a và b (mol)
Ta có:
\(\left\{ \matrix{
{m_X} = 158a + 122,5b = 48,2 \hfill \cr
\buildrel {BTe} \over
\longrightarrow 5a + 6b = 0,15.4 + 0,675.2 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
a = 0,15 \hfill \cr
b = 0,2 \hfill \cr} \right.\)
BTNT “Mn”: nMnCl2 = nKMnO4 = 0,15 (mol)
BTNT “K’: nKCl = nKMnO4 + nKClO3 = 0,15 + 0,2 = 0,35 (mol)
BTNT “Cl”: nKClO3 + nHCl = 2nMnCl2 + nKCl + 2nCl2 => nHCl = 2.0,15 + 0,35 +2.0,675 – 0,2 = 1,8 (mol)
Biết nồng độ mol/l của dung dịch B gấp 4 lần nồng độ mol/l của dung dịch A. Nồng độ mol/l của dung dịch A và dung dịch B lần lượt là
Đặt nồng độ mol dung dịch A là x (mol/l)
=> Nồng độ mol dung dịch B là 4x (mol/l)
Số mol HCl trong dung dịch A: \(\dfrac{x}{3}\) (mol)
Số mol HCl trong dung dịch B: \(\dfrac{2}{3}.4x = \dfrac{{8x}}{3}mol\)
Số mol HCl trong dung dịch C: \(\dfrac{x}{3} + \dfrac{{8x}}{3} = 0,6 \Rightarrow x = 0,2\)
=> Nồng độ mol dung dịch A là x=0,2 (mol/l). Nồng độ mol dung dịch B là 4x=4.0,2=0,8 (mol/l)
Nồng độ mol/l của dung dịch C là
\({n_{AgCl}} = \dfrac{{8,61}}{{143,5}} = 0,06mol\)
\(\begin{array}{*{20}{c}}{AgN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HCl}\\{0,06}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{AgCl \downarrow }\\{0,06}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{HN{O_3}}\\{}\end{array}\)
Số mol của HCl trong 1/10 dung dịch là 0,06 mol
=> Số mol HCl trong dung dịch 0,06.10=0,6 mol
\({C_M} = \dfrac{{0,6}}{1} = 0,6M\)
Hiện tượng của phản ứng là
\(AgN{O_3} + HCl \to AgCl \downarrow + HN{O_3}\)
AgCl là kết tủa trắng
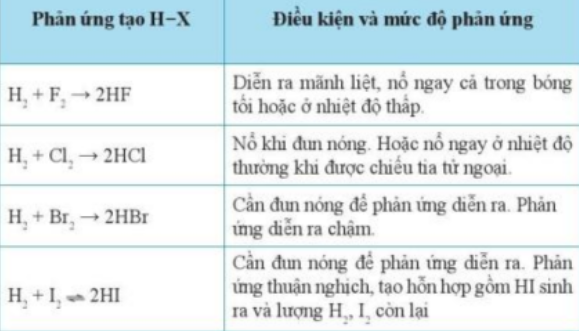
Phát biểu nào sau đây đúng?
Có tính phi kim của các nguyên tố halogen giảm dần từ F2 đến I2. Phản ứng với H2 chứng minh sự biến đổi đó
Cho hỗn hợp Y qua 40 gam dung dịch KOH 14% nung nóng được dung dịch Z. Khối lượng muối clorua trong Z là
Số mol KOH ban đầu: \(C\% = \dfrac{{{m_{KOH}}}}{{{m_{{\rm{dd}}KOH}}}}.100\% \Leftrightarrow 14\% = \dfrac{{56.{n_{KOH}}}}{{40}}.100\% \Leftrightarrow {n_{KOH}} = 0,1mol\)
\(\begin{array}{*{20}{c}}{HCl}\\{0,06}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{KOH}\\{0,06}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{KCl}\\{0,06}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{{H_2}O}\\{}\end{array}\)
\(\begin{array}{*{20}{c}}{3C{l_2}}\\{0,0075}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{6KOH}\\{0,015}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{5KCl}\\{0,0125}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{KCl{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{3{H_2}O}\\{}\end{array}\)
Áp dụng BTKL:
Khối lượng dung dịch Z = \({m_{C{l_2}}} + {m_{HCl}} + {m_{{\rm{dd}}KOH}} = 0,0075.71 + 0,06.36,5 + 40 = 42,7225g\)
\({C_{\% (KCl)}} = \dfrac{{{m_{KCl}}}}{{{m_{{\rm{dd}}Z}}}}.100\% = \dfrac{{(0,06 + 0,0125).74,5}}{{42,7225}}.100\% \simeq 12,64\% \)
Số mol các khí trong Y là
\({n_X} = \dfrac{{4,48}}{{22,4}} = 0,2mol\)
\({H_2} + C{l_2} \to 2HCl\)
Từ phương trình hóa học ta thấy nếu sử dụng 1 mol H2 và 1 mol Cl2 tạo ra 2 mol HCl. Như vậy trong bình kín lượng khí mất đi và tạo ra bằng nhau, do đó tổng số mol hỗn hợp X bằng tổng số mol trong hỗn hợp Y
Hỗn hợp Y trong đó có 30% HCl về thể tích \( \Rightarrow \)Số mol HCl trong Y là 30%.0,2=0,06 mol
\( \Rightarrow \)Số mol H2 phản ứng = Số mol Cl2 phản ứng bằng 0,06/2=0,03 mol
Số mol Cl2 còn 20% nên đã tham gia phản ứng là 80%
\( \Rightarrow \)Số mol Cl2 ban đầu trong hỗn hợp X là \(\dfrac{{0,03.100}}{{80}} = 0,0375mol\)
\( \Rightarrow \)Số mol H2 ban đầu: 0,2-0,0375=0,1625 mol
Trong hỗn hợp Y có:
Số mol HCl = 0,06 mol
Số mol Cl2 dư = 0,0375-0,03=0,0075 mol
Số mol H2 dư = 0,1625-0,03=0,1325 mol
Hòa tan 11,2 lít khí HCl (đktc) vào m gam dung dịch HCl 16%, thu được dung dịch HCl 20%. Giá trị của m là
\(\begin{array}{l}{n_{HCl}} = 0,5\,\,(mol)\\16 = \dfrac{{{m_{HCl}}}}{m}.100 = > {m_{HCl}} = \dfrac{{16m}}{{100}}(gam) = > {n_{HCl}} = \dfrac{{16m}}{{100.\,\,36,5}}(mol)\\ = > \sum {{n_{HCl}} = } \dfrac{{16m}}{{100.\,\,36,5}} + 0,5\,(mol) = > {m_{HCl}} = (\dfrac{{16m}}{{100.\,\,36,5}} + 0,5).\,\,36,5\,(gam)\end{array}\)
mdd sau phản ứng = mHCl + m = 0,5. 36,5 + m = m+ 18,25 (gam)
\(\begin{array}{l}20 = \dfrac{{{m_{HCl}}}}{{{m_{{\rm{dd}}\,sau\,pu}}}}.100\% \\ < = > \,20 = \dfrac{{(\dfrac{{16m}}{{100.\,\,36,5}} + 0,5).\,\,36,5}}{{m + 18,25}}.100\\ < = > m = 365\,(gam)\end{array}\)
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
nH2(ĐKTC) = 3,36 : 22,4 = 0,15 (mol)
Cho Ag và Al phản ứng với HCl dư, chỉ có Al tham gia phản ứng
2Al + 6HCl → 2AlCl3 +3H2↑
0,1 ← 0,15 (mol)
=> mAl = 0,1.27 = 2,7 (g)
%Al = (mAl/ mhh).100% = (2,7/5).100% = 54,0%
Phản ứng trung hòa acid HCl trong dịch vị dạ dày và giảm đau dạ dày (uống sau bữa ăn) là
\(NaHC{O_3} + HCl \to NaCl + C{O_2} + {H_2}O\)
Hòa tan V lít khí HCl (đktc) vào 185,4 gam dung dịch HCl 10% thu được dung dịch HCl 16,57%. Giá trị của V là
\(\begin{array}{l}{m_{HCl}} = 185,4.\,\,\dfrac{{10}}{{100}} = 18,54\,gam = > {n_{HCl}} = \dfrac{{18,54}}{{36,5}}(mol)\\\sum {{n_{HCl}} = \dfrac{V}{{22,4}} + } \dfrac{{18,54}}{{36,5}}(mol)\\{m_{{\rm{dd}}\,sau\,pu}} = \dfrac{V}{{22,4}}.36,5 + 185,4\,(gam)\\16,57 = \dfrac{{(\dfrac{V}{{22,4}} + \dfrac{{18,54}}{{36,5}}).\,\,36,5}}{{\dfrac{V}{{22,4}}.36,5 + 185,4}}.100\\ < = > V = 8,96\,\,lit\end{array}\)
Công thức hóa học của natri bicarbonate là
Natri bicarbonate là NaHCO3
Hãy chỉ ra mệnh đề không chính xác
Mệnh đề không chính xác là “Tất cả muối AgX (X là halogen) đều không tan trong nước”
Dãy các chất nào sau đây đều tác dụng với axit clohiđric ?
Dãy các chất nào sau đây đều tác dụng với axit clohiđric là: Fe2O3, KMnO4, Fe, CuO, AgNO3
Phản ứng trong đó HCl thể hiện tính khử là
A, D: HCl đóng vai trò là chất trao đổi
B: HCl đóng vai trò chất oxi hóa \(2\mathop H\limits^{ + 1} + 2{\rm{e}} \to {\mathop H\limits^0 _2}\)
C:\({\rm{ }}\mathop {Cl}\limits^{ - 1} \to {\mathop {Cl}\limits^0 _2} + 2{\rm{e}}\) => HCl là chất khử
Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là
Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là Zn

