Phản ứng nào sau đây không điều chế được chlorine?
Khi không có màng ngăn, NaOH tiếp tục tác dụng với Cl2
\(2NaOH + C{l_2} \to NaCl + NaClO + {H_2}O\)
Cuối cùng không thu được chlorine
Khi cho 21,75 gam mangan đioxit rắn tác dụng với axit clohiđric đậm đặc đun nóng thì thể tích clo thu được ở đktc là:
PTHH xảy ra: MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
Theo PT ta có: nCl2 = nMnO2 = 21,75 : 87 = 0,25 mol
Suy ra VCl2 = 0,25.22,4 = 5,6 lít
Cho 26,1 gam MnO2 tác dụng hết với dung dịch HCl đặc, toàn bộ lượng clo sinh ra được hấp thụ hết vào 500 ml dung dịch NaOH 2M. Coi thể tích dung dịch không thay đổi, nồng độ mol của NaCl trong dung dích sau phản ứng là
\({n_{Mn{O_2}}} = \dfrac{{26,1}}{{55 + 2.16}} = 0,3mol\)
\({n_{NaOH = }}0,5.2 = 1mol\)
\(\begin{array}{*{20}{c}}{Mn{O_2}}\\{0,3}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{4HCl}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{MnC{l_2}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{C{l_2}}\\{0,3}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{2{H_2}O}\\{}\end{array}\)
\(\begin{array}{*{20}{c}}{2NaOH}\\1\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{C{l_2}}\\{0,3}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{NaCl}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{NaClO}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{{H_2}O}\\{}\end{array}\)⇒ NaOH dư, Cl2 hết
=> Số mol của NaCl=0,3 mol
=> \({C_{M(NaCl)}} = \dfrac{{0,3}}{{0,5}} = 0,6M\)
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
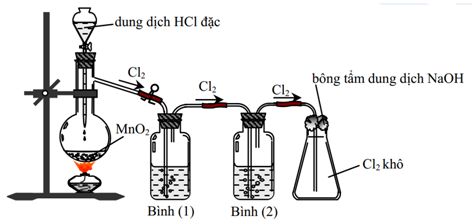
Cho các phát biểu sau:
(a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước
(b) Có thể đổi vị trí bình (1) và bình (2) cho nhau
(c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường
(d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất
(e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4
(f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên)
Số phát biểu không đúng là:
(a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước
=> Đúng
(b) Có thể đổi vị trí bình (1) và bình (2) cho nhau
=> Sai. Bình hấp thu nước luôn để sau cùng vì các quá trình khác luôn có hơi nước lẫn vào
(c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường
=> Đúng
(d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất
=> Sai. Dùng dung dịch MCl bão hòa (NaCl) vì NaCl hấp thụ tốt HCl
Giải thích: Cl2 phản ứng với H2O theo cân bằng:
Cl2 + H2O ↔ HCl + HClO.
Trong dung dịch NaCl bão hòa thì nồng độ của ion Cl- rất lớn => cân bằng dịch chuyển theo chiều nghịch
=> giảm độ tan của Cl2
(e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4
=> Đúng. [KMnO4 + HCl (H2SO4 + NaCl) ]
(f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên)
=> Sai. Vì CaO + H2O tạo ra Ca(OH)2 có thể phản ứng với Cl2
Vậy có 3 phát biểu không đúng
Cần thể tích clo (đktc) là bao nhiêu để tác dụng vừa đủ với sắt tạo ra 0,2 mol FeCl3 ?
Tính toán theo PTHH: 2 Fe + 3 Cl2 → 2 FeCl3
n FeCl3 = 0,2 mol
theo PTHH: n Cl2 = n FeCl3. 3: 2 = 0,2. 3: 2 = 0,3 mol
=> VCl2 = 0,3. 22,4 = 6,72 lít
Cho 13,44 lít khí clo ( đktc) đi qua 2,5 lít dung dịch KOH ở 1000C. Sau khi phản ứng xảy ra hoàn toàn, thu được 37, 25 gam KCl. Dung dịch KOH trên có nồng độ
n Cl2 = 0,6 mol
n KCl = 0,5 mol
Theo PTHH:: 6 KOH + 3 Cl2 to→ 5 KCl + KClO3 + 3 H2O
0,6 mol → 0,5 mol
Vậy Clo dư sau pư: n KOH = n KCl . 6: 5 = 0,6 mol
=> CM KOH = 0,6: 2,5 = 0,24 M
Hấp thụ hoàn toàn 2,24 lít Cl2 bằng dung dịch NaOH vừa đủ, sau phản ứng thu được dung dịch X, cô cạn dung dịch X được m gam rắn khan. Giá trị của m là:
nCl2 = 0,1 mol
PTHH: 2NaOH + Cl2 → NaCl + NaClO + H2O
0,2 ← 0,1 → 0,1 → 0,1 → 0,1 (mol)
Chất rắn khan gồm: 0,1 mol NaCl và 0,1 mol NaClO
=> m chất rắn = 0,1.58,5 + 0,1.74,5 = 13,3 gam
Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư. Dung dịch thu được có các chất thuộc dãy nào dưới đây ?
Cl2 tác dụng với dung dịch dung dịch KOH đặc, nóng, dư : 3Cl2 + 6KOH (to)-> 5KCl + KClO3 + 3H2O
Chất được dùng để làm khô khí clo ẩm là
Chất được dùng để làm khô khí clo ẩm là dung dịch H2SO4 đặc. Vì Cl2 và H2SO4 đặc đều là những chất oxi hóa mạnh nên không phản ứng với nhau.
Ứng dụng nào sau đây không phải của clo?
Clo không được dùng để sản xuất axit sunfuric
Sản phẩm của phản ứng đốt dây sắt trong khí clo dư là
2Fe + 3Cl2 (t0)→ 2FeCl3
Ứng dụng không phải của clo là
Ứng dụng không phải của clo là: Sản xuất chất dẻo teflon làm chất chống dính ở xoong, chảo
Khí Cl2 không tác dụng với
Clo không tác dụng với khí O2
Trong phản ứng hóa học sau, Clo đóng vai trò là
\(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl\)
\({\mathop {Cl}\limits^0 _2}\; + \;2{\rm{e}} \to \;2\mathop {Cl}\limits^{ - 1} \;\)
=> Clo là chất oxi hóa
Trong công nghiệp, để điều chế clo, người ta có thể làm như sau
Phương pháp điều chế khí clo trong công nghiệp là: Điện phân dung dịch NaCl, màng ngăn xốp.
Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
Để điều chế clo ta cho dung dịch HCl đặc tác dụng với MnO2, đun nóng
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Trong các halogen, clo là nguyên tố
Clo là nguyên tố tồn tại trong vỏ Trái Đất (dưới dạng các hợp chất) với trữ lượng lớn nhất
Ứng dụng nào sau đây không phải của clo ?
Ứng dụng không phải của clo là: tinh chế dầu mỏ
Ở điều kiện thường clo là chất khí màu
Ở điều kiện thường Clo là chất khí màu vàng nhạt là Cl2
Trong tự nhiên, clo tồn tại chủ yếu dưới dạng
Tính chất vật lí của khí clo là: Chất khí, màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí và tan được trong nước, clo là khí độc.

