Liên kết ion là liên kết được tạo thành bởi
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu
Nhận định không chính xác về liên kết ion là:
Nhận định không chính xác về liên kết ion là: Được hình thành bởi các cặp e chung.
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu
Các ion S2-, Cl-, K+, Ca2+ đều có cấu hình là [Ne]3s23p6. Dãy sắp xếp theo chiều tăng dần bán kính các ion là
Do các ion trên đều có cầu hình giống nhau => Số lớp electron giống nhau => Bán kính nguyên tử phụ thuộc vào lực hút giữa electron với hạt nhân nguyên tử
Với ion dương: giá trị điện tích ion càng lớn thì lực hút càng mạnh => Bán kính giảm
Với ion âm: giá trị điện tích ion càng lớn thì lực hút càng yếu => Bán kính tăng
=> Chiều sắp xếp tăng dần bán kính các ion là Ca2+, K+, Cl-, S2-
Các nguyên tử kết hợp lại với nhau nhằm mục đích tạo thành cấu trúc mới
Các nguyên tử kết hợp lại với nhau nhằm mục đích tạo thành cấu trúc mới bền vững hơn cấu trúc ban đầu.
Cho mô hình cấu tạo nguyên tử của Q và R như sau:
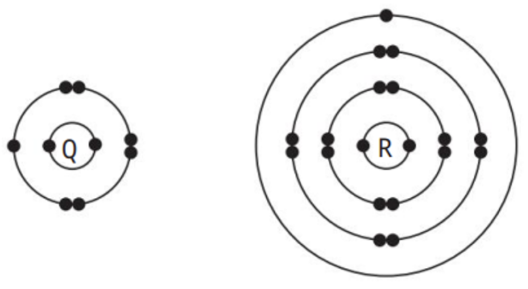
Công thức của hợp chất ion được tạo thành từ Q và R là
Để đạt cấu hình của khí hiếm bền vững, Q nhận thêm 1e, R nhường đi 1e
=> Hình thành ion Q- và R+
=> Hợp chất ion tạo thành giữa Q và R là QR
Chất nào sau đây chứa liên kết ion?
Liên kết giữa K và Cl là liên kết ion.
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
Bước 1: Xác định tính kim loại, phi kim của X, Y
11X: 1s22s22p63s1 => X là kim loại điển hình (nhóm IA)
17Y: 1s22s22p63s23p5 => Y là phi kim điển hình (nhóm VIIA)
Bước 2: Xác định liên kết giữa X, Y
Như vậy liên kết giữa X và Y là liên kết ion
X là nguyên tố ở chu kì 3, nhóm IIIA và Y là nguyên tố ở chu kì 2, nhóm VIA. Công thức và loại liên kết của hợp chất tạo bởi X và Y có thể là:
X ở nhóm IIIA nên dễ nhường 3e để đạt cấu hình của khí hiếm
Y ở nhóm VIA nên dễ nhận 2e để đạt cấu hình khí hiếm
=> CTHH: X2Y3
X là kim loại điển hình còn Y là phi kim điển hình nên liên kết giữa X và Y là liên kết ion.
Khi tạo thành liên kết ion, nguyên tử dễ nhường electron là nguyên tử
Khi tạo thành liên kết ion, nguyên tử dễ nhường electron là nguyên tử có năng lượng ion hóa nhỏ hơn.
Theo quy tắc bát tử thì nguyên tử của nguyên tố X có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron bền vững của các khí hiếm với a electron ở lớp ngoài cùng. Giá trị của a là
* Quy tắc bát tử: các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình bền bững của khí hiếm với 8 electron (hoặc của Heli với 2 electron) ở lớp ngoài cùng.
=> giá trị của a là 8 hoặc 2
Oxi có số hiệu nguyên từ là 8. Oxi dễ dàng:
Oxi có số hiệu nguyên từ là 8 => Cấu hình e của oxi là: 1s22s22p4
=> O thiếu 2e để đạt cấu hình bền của khí hiếm => dễ dàng nhận 2e để tạo thành ion
Natri có số hiệu nguyên tử là 11. Natri dễ dàng:
Natri có số hiệu nguyên tử là 11 => Cấu hình e của Na là: 1s22s22p63s1
=> Na thừa 1e để tạo thành cấu hình bền của khí hiếm => dễ dàng nhường 1e để tạo thành ion
Số electron lớp ngoài cùng của ion S2- (Z = 16) là:
Nguyên tố S có Z = 16 => cấu hình e của S là: 1s22s22p63s23p4
Nguyên tử S nhận thêm 2e để tạo thành ion S2-
=> Cấu hình e của ion S2- là: 1s22s22p63s23p6
=> Số electron lớp ngoài cùng của S2- là 2 + 6 = 8
Cấu hình e lớp ngoài cùng của ion K+ (Z = 19) là:
Cấu hình e của K (Z = 19) là: 1s22s22p63s23p64s1
Nguyên tử K cho 1e để tạo thành ion K+
=> Cấu hình e của ion K+ là: 1s22s22p63s23p6
=> Cấu hình e lớp ngoài cùng của ion K+ : 3s23p6.
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
Cấu hình e của Al: 1s22s22p63s23p1
=> nguyên tử Al cần cho 3e để đạt cấu hình bền vững của Ne (1s22s22p6)
Cho các nguyên tố R (Z = 8), X (Z = 9) và Y (Z = 16). Các ion được tạo ra từ nguyên tử các nguyên tố trên là
R (Z = 8) có cấu hình e: 1s22s22p4 => dễ nhận 2e tạo cấu hình bền => ion tạo ra là R2-
X (Z = 9) có cấu hình e: 1s22s22p5 => dễ nhận 1e tạo cấu hình bền => ion tạo ra là X-
Y (Z = 16) có cấu hình e: 1s22s22p63s23p4 => dễ nhận 2e để tạo cấu hình bền => ion tạo ra là Y2-
Khi hình thành phân tử NaCl từ natri và clo
Khi hình thành phân tử NaCl từ natri và clo : nguyên tử natri nhường một electron cho nguyên tử clo để tạo thành các ion dương và âm tương ứng, các ion này hút nhau tạo thành phân tử.
Cho nguyên tố 11Na và 17Cl. Trong phân tử NaCl, cấu hình electron của các ion là
Na (Z = 11) có cấu hình e: 1s22s22p63s1
Trong phân tử NaCl, Na có hóa trị I => Na cho 1e tạo cấu hình bền
=> cấu hình e của Na+ là 1s22s22p6
Cl (Z = 17) có cấu hình e: 1s22s22p63s23p5
Trong phân tử NaCl, Cl có hóa trị I => Cl nhận 1e tạo cấu hình bền
=> cấu hình e của Cl- : 1s22s22p63s23p6
Hợp chất không chứa ion đa nguyên tử là:
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm
VD: NH4+, OH-, SO42-,…
=> Các hợp chất chứa ion đa nguyên tử là : NH4Cl, Na2CO3, (NH4)2CO3.
Hợp chất không chứa ion đa nguyên tử là: NaCl
Cấu hình e của nguyên tử X là 1s22s22p63s23p64s2, của nguyên tử Y là 1s22s22p5. Hợp chất tạo thành giữa X và Y là
X : 1s22s22p63s23p64s2 => dễ cho 2e để tạo cấu hình bền (1s22s22p63s23p6)
Y: 1s22s22p5 => dễ nhận 1e để tạo cấu hình bền
=> 2 nguyên tử Y nhận 2e của 1 nguyên tử X để tạo hợp chất bền
=> công thức phân tử: XY2

