Hợp chất trong phân tử có liên kết ion là
Hợp chất trong phân tử có liên kết ion là NaCl
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
Na có Z = 11 => số e = 11 => ion Na+ có số e = 11 – 1 = 10
Mg có Z = 12 => số e = 12 => ion Mg2+ có số e = 12 – 2 = 10
Al có Z = 13 => số e = 13 => ion Al3+ có số e = 13 – 3 = 10
Ca có Z = 20 => số e = 20 => ion Ca2+ có số e = 20 – 2 = 18
S có Z = 16 => số e = 16 => ion S2- có số e = 16 + 2 = 18
Cl có Z = 17 => số e = 17 => ion Cl- có số e = 17 + 1 = 18
O có Z = 8 => số e = 8 => ion O2- có số e = 8 + 2 = 10
Vậy có 4 ion có 10e
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 3 lớp e là:
Viết cấu hình e của các nguyên tử => cấu hình e của ion tương ứng
Na(Z=11): 1s2 2s2 2p6 3s1 => Na+ : 1s2 2s2 2p6
Mg(Z=12): 1s2 2s2 2p6 3s2 => Mg2+ : 1s2 2s2 2p6
Al(Z=13): 1s2 2s2 2p6 3s2 3p1 => Al3+: 1s2 2s2 2p6
O(Z=8): 1s2 2s2 2p4 => O2-: 1s2 2s2 2p6
Ca(Z=20): 1s2 2s2 2p6 3s2 3p6 4s2 => Ca2+: 1s2 2s2 2p6 3s2 3p6
S(Z = 16) 1s2 2s2 2p6 3s2 3p4 =>S2-: 1s2 2s2 2p6 3s2 3p6
Cl (Z=17) 1s2 2s2 2p6 3s2 3p5 => Cl- 1s2 2s2 2p6 3s2 3p6
=> 3 ion có 3 lớp e là : Ca2+, S2-, Cl-
Cation R+ có cấu hình e ở phân lớp ngoài cùng là 2p6. Vậy R là:
Cation R+ có e ở phân lớp ngoài cùng là 2p6 => cấu hình e của R+ là : 1s22s22p6
=> cấu hình e của R là : 1s22s22p63s1
Số e lớp ngoài cùng của R là 1 => R là kim loại
Nguyên tố X thuộc nhóm IIA, chu kỳ 2 còn nguyên tố Y thuộc nhóm VIIA, chu kỳ 3 trong bảng hệ thống tuần hoàn. Công thức của hợp chất giữa X và Y là:
X thuộc nhóm IIA, chu kỳ 2 => X có cấu hình e:1s22s2 => X cần cho đi 2e để đạt cấu hình bền của khí hiếm
Y thuộc nhóm VIIA, chu kỳ 3 => Y có cấu hình e: 1s22s22p63s23p5 => Y cần nhận thêm 1e để đạt cấu hình bền của khí hiếm
=> Công thức tạo bởi X và Y là XY2
Cho Na (Z=11) và Cl (Z=17). Liên kết trong phân tử NaCl là
Liên kết trong phân tử NaCl là liên kết ion.
Ion nào sau đây là ion đa nguyên tử
- S2-: được tạo bởi nguyên tử S
- Al3+: được tạo bởi nguyên tử Al
- NH4+: được tạo bởi nguyên tử N và H
- Ca2+: được tạo bởi nguyên tử Ca
Vậy NH4+ là ion đa nguyên tử
Chỉ ra nội dung sai khi nói về ion:
A sai vì ion âm được gọi là anion còn ion dương được gọi là cation.
Ion nào là ion đơn nguyên tử?
Cl- là ion đơn nguyên tử.
Liên kết ion là liên kết được hình thành bởi
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Chất nào sau đây chứa liên kết ion? (Cho giá trị độ âm điện của các nguyên tố như sau: N = 3,04; C = 2,55; H = 2,20; K = 0,82 ; Cl = 3,16)
A. Δχ= χCl – χK = 3,16 – 0,82 = 2,34 > 1,7 => liên kết ion
B. Δχ= χC – χH = 2,55 – 2,2 = 0,35 < 0,4 => liên kết CHT không cực
C. Δχ= χN – χH = 3,04 – 2,2 = 0,84 => liên kết CHT có cực
D. Δχ= 0 => liên kết CHT không cực
Muối ăn là hợp chất rất quan trọng đối với con người. Liên kết hóa học trong tinh thể muối ăn thuộc loại liên kết nào?
Liên kết giữa kim loại điển hình (IA, IIA) và phi kim điển hình (VIIA, VIA) là liên kết ion.
Muối ăn là NaCl.
Ta thấy Na là kim loại điển hình (nhóm IA) và Cl là phi kim điển hình (nhóm IIA) nên liên kết trong tinh thể muối ăn là liên kết ion.
Liên kết hóa học được hình thành trong phân tử kali bromua là
K là kim loại điển hình – kim loại kiềm và Br là phi kim điển hình – halogen => Liên kết hóa học được hình thành trong phân tử kali bromua là liên kết ion
Tổng số hạt trong nguyên tử M và nguyên tử X bằng 86, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Số khối của X lớn hơn của M là 12. Tổng số hạt trong nguyên tử X nhiều hơn trong nguyên tử M là 18 hạt.
Cho các phát biểu sau:
(1) M là kim loại.
(2) M với X tạo với nhau liên kết cộng hóa trị.
(3) X thuộc nhóm VIIA.
(4) X có độ âm điện lớn nhất trong các nguyên tố của bảng tuần hoàn.
Số phát biểu đúng là
Gọi số p, n, e trong nguyên tử M là P1, E1, N1
trong nguyên tử X là P2, E2, N2.
Ta có các phương trình:
2P1 + N1 + 2P2 + N2 = 86
2P1 + 2P2 - (N1 + N2) = 26
(P1 + N1) + 12 = P2 + N2
2P1 + N1 + 18 = 2P2 + N2,
Giải hệ phương trình ta được cập nghiệm thỏa mãn:
M: P1 = 11; N1 = 12, vậy M là natri
X: P2 = 17; N2 = 18, vậy X là clo.
Cấu hình electron: M: 1s2 2s2 2p6 3s1 ; X: 1s2 2s22p6 3s2 3p5.
M là kim loại điển hình (vì lớp ngoài cùng có 1 electron)
X là phi kim điển hình (vì lớp ngoài cùng có 7 electron).
Vậy liên kết hoá học giữa M và X thuộc loại liên kết ion.
Các phát biểu đúng là (1), (3)
Potassium iodine (KI) được sử dụng như một loại thuốc chống long đờm, giúp làm lỏng và phá vỡ chất nhầy trong đường thở, thường dùng cho các bệnh nhân hen suyễn, viêm phế quản mãn tính. Trong trường hợp bị nhiễm phóng xạ, KI còn giúp ngăn tuyến giáp hấp thụ iodine phóng xạ, bảo vệ và giảm nguy cơ ung thư tuyến giáp. Biết số hiệu nguyên tử của K và I lần lượt là 19 và 53. Trong phân tử KI, nguyên tử K và I đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
K (Z=19): 1s22s22p63s23p64s1 => Để đạt cấu hình của khí hiếm gần nhất, K có xu hướng cho đi 1 electron
I (Z=53): 1s22s22p63s23p63d104s24p64d105s25p5 => Để đạt cấu hình của khí hiếm gần nhất, I có xu hướng nhận vào 1 electron
Nguyên tử nào sau đây để đạt được cấu hình electron bền của khí hiếm neon có 8e lớp ngoài ở lớp thứ 2 bằng cách nhận vào 2 electron?
Neon: 1s22s22p6
Fluorine (Z=9): 1s22s22p5 => Để đạt cấu hình của khí hiếm neon, F nhận vào 1 electron
Sodium (Z=11): 1s22s22p63s1 => Để đạt cấu hình của khí hiếm neon, Na cho đi 1 electron
Oxygen (Z=8): 1s22s22p4 => Để đạt cấu hình của khí hiếm neon, O nhận vào 2 electron
Magnesium (Z=12): 1s22s22p63s2 => Để đạt cấu hình của khí hiếm neon, Mg cho đi 2 electron
Cho số hiệu nguyên tử của N, H, Cl, P, S lần lượt là 7, 1, 17, 15, 16. Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Cấu hình electron nguyên tử của các nguyên tố:
- N (Z=7): 1s22s22p3
- H (Z=1): 1s2
- Cl (Z=17): 1s22s22p63s23p5
- P (Z=15): 1s22s22p63s23p3
- S (Z=16): 1s22s22p63s23p4
Biểu diễn các electron lớp ngoài cùng bằng các dấu chấm
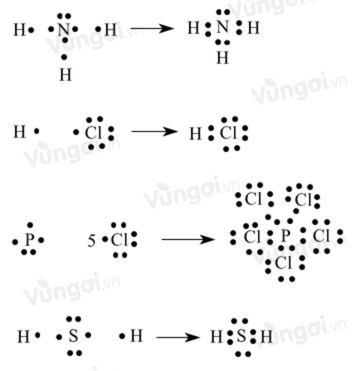
Nhận thấy P trong PCl5 khi tham gia liên kết có 10 electron, nhiều hơn 8 electron theo quy tắc octet nên PCl5 không tuân theo quy tắc octet
Cho số hiệu nguyên tử của C và S lần lượt là 6 và 16. Phát biểu nào sau đây không đúng khi nói về hợp chất CS2?
Cấu hình electron của
- C (Z=6): 1s22s22p2
- S (Z=16): 1s22s22p63s23p4
Trong phân tử CS2, để đạt cấu hình electron của khí hiếm gần nhất, C cần nhận vào 4 electron và mỗi S cần nhận vào 2 electron => C góp 2 electron với 2 electron độc thân của một nguyên tử S
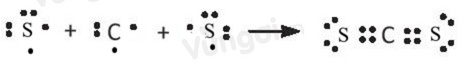
A đúng
B sai. Nguyên tử C không còn cặp electron lớp ngoài cùng chưa tham gia liên kết, một nguyên tử S còn 2 cặp electron lớp ngoài cùng chưa tham gia liên kết => CS2 có tổng số cặp electron lớp ngoài cùng chưa tham gia liên kết là 2.2=4 cặp
C đúng với quy ước một cặp electron là một liên kết đơn
D đúng vì cả C và S sau khi hình thành liên kết đều có 8 electron lớp ngoài cùng giống với cấu hình bền của khí hiếm
Nguyên tử nguyên tố nào sau đây có xu hướng nhận vào 2 electron khi hình thành liên kết hóa học?
Potassium (Z=19): 1s22s22p63s23p64s1 => Để đạt cấu hình của khí hiếm gần nhất, K có xu hướng nhường đi 1 electron
Calcium (Z=20): 1s22s22p63s23p64s2 => Để đạt cấu hình của khí hiếm gần nhất, Ca có xu hướng nhường đi 2 electron
Sulfur (Z=16): 1s22s22p63s23p4 => Để đạt cấu hình của khí hiếm gần nhất, S có xu hướng nhận vào 2 electron
Nitrogen (Z=7): 1s22s22p3 => Để đạt cấu hình của khí hiếm gần nhất, N có xu hướng nhận vào 3 electron
Cho các phân tử sau: Cl2, H2O, NaF, CH4. Biết số hiệu nguyên tử của Cl, H, O, Na, F, C lần lượt là 17, 1, 8, 11, 9, 6. Số chất có nguyên tử nguyên tố nhường đi 1 electron khi hình thành liên kết hóa học?
Cấu hình electron nguyên tử của nguyên tố
- Cl (Z=17): 1s22s22p63s23p5 => Để đạt cấu hình electron của khí hiếm gần nhất, Cl cần nhận vào 1 electron
=> Trong phân tử Cl2 mỗi nguyên tử Cl góp chung 1 electron tạo 1 cặp electron dùng chung
- H (Z=1): 1s1 => Để đạt cấu hình electron của khí hiếm gần nhất, H cần nhận vào 1 electron
- O (Z=8): 1s22s22p4 => Để đạt cấu hình electron của khí hiếm gần nhất, O cần nhận vào 2 electron
=> Trong phân tử H2O, mỗi nguyên tử O sẽ góp chung 1 electron độc thân với 1 electron độc thân của H. Từ đó tạo nên 2 cặp electron dùng chung giữa O và 2H
- Na (Z=11): 1s22s22p63s1 => Để đạt cấu hình electron của khí hiếm gần nhất, Na cần nhường đi 1 electron
- F (Z=9): 1s22s22p5 => Để đạt cấu hình electron của khí hiếm gần nhất, F cần nhận thêm 1 electron
=> Trong phân tử NaF, Na nhường đi 1 electron, F nhận 1 electron mà Na nhường
- C (Z=6): 1s22s22p2 => Để đạt cấu hình của khí hiếm gần nhất, C cần nhận thêm 4 electron
=> Trong phân tử CH4, C góp 1 electron với 1 electron của một H, từ đó tạo nên 4 cặp electron dùng chung
=> Chất thỏa mãn là NaF

