Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 1 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Z=19: 1s22s22p63s23p64s1 => Để đạt cấu hình bền vững, nguyên tử có xu hướng nhường đi 1 electron
Z=10: 1s22s22p6 (cấu hình đã bền vững)
Z=9: 1s22s22p5 => Để đạt cấu hình bền vững, nguyên tử có xu hướng nhận vào 1 electron
Z=8: 1s22s22p4 => Để đạt cấu hình bền vững, nguyên tử có xu hướng nhận vào 2 electron
Cho số hiệu nguyên tử của Na và S là 11 và 16. Để hình thành liên kết hóa học trong phân tử Na2S, nguyên tử S
Na (Z=11): 1s22s22p63s1 => Để đạt cấu hình electron bền vững, Na nhường đi 1 electron
S (Z=16): 1s22s22p63s23p4 => Để đạt cấu hình electron bền vững, S nhận vào 2 electron
Để tạo liên kết trong Na2S, mỗi nguyên tử Na nhường đi 1 electron hóa trị duy nhất để tạo thành cation Na+. Nguyên tử S có 6 electron hóa trị nhận thêm 2 electron từ hai nguyên tử Na tạo ion S2-
Cho các nguyên tố có số hiệu nguyên tử lần lượt là Z=8, Z=11, Z=12, Z=17, Z=18. Số nguyên tố có xu hướng cần nhận thêm 2 electron khi tham gia liên kết hóa học là
Z=8: 1s22s22p4 => Xu hướng nhận vào 2 electron
Z=11: 1s22s22p63s1 => Xu hướng cho đi 1 electron
Z=12: 1s22s22p63s2 => Xu hướng cho đi 2 electron
Z=17: 1s22s22p63s23p5 => Xu hướng nhận thêm 1 electron
Z=18: 1s22s22p63s23p6 (Cấu hình bền vững)
Hai ion X+ và Y- có cùng cấu hình electron. Khẳng định nào dưới đây đúng?
\(X \to {X^ + } + 1e\) => Để tạo thành cấu hình của X thì X+ cộng thêm 1e
\(Y + 1e \to {Y^ - }\) => Để tạo thành cấu hình của Y thì Y- mất đi 1e
=> X nhiều hơn Y 2e => A đúng
Cho mô hình cấu tạo nguyên tử của nguyên tố X và Y như sau:
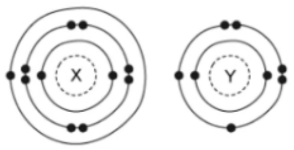
Công thức hợp chất ion tạo thành giữa X và Y là
Để đạt cấu hình của khí hiếm bền vững thì X nhường đi 1e, Y nhận thêm 2e
=> Hình thành ion X+ và Y2-
=> Hợp chất ion tạo thành giữa X và Y là X2Y

