Chọn câu đúng nhất: Độ âm điện của một nguyên tử đặc trưng cho
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Độ âm điện của một nguyên tử đặc trưng cho:
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng thì bán kính nguyên tử
Trong cùng một nhóm A, theo chiều điện tích hạt nhân tăng dần số lớp e tăng nên bán kính tăng dần
Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì điều khẳng định đúng là:
Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì bán kính nguyên tử tăng dần.
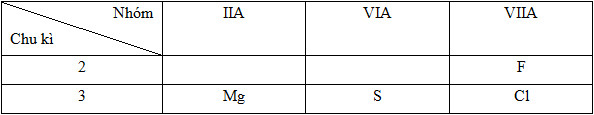
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
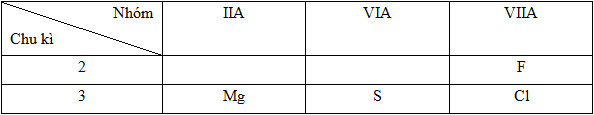
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1. Tính chất nào sau đây của nguyên tố X là không đúng?
Nguyên tử của nguyên tố X có cấu hình electron là 1s22s22p63s23p64s1
→ ZX = 19 → X là Kali (K).
A đúng, vì K tác dụng mạnh với nước ở nhiệt độ thường theo phản ứng: 2K + 2H2O → 2KOH + H2↑
B đúng, vì hợp chất của K với Cl là KCl là một hợp chất ion.
C sai, vì nguyên tử K dễ nhường đi 1 electron để tạo cấu hình lớp vỏ ngoài cùng 3s23p6 bền vững.
D đúng, vì hợp chất của K với oxi là K2O, có thể phản ứng với H2O tạo dung dịch KOH có môi trường bazo theo phản ứng: K2O + H2O → 2KOH.
Độ âm điện là:
Độ âm điện là khả năng hút e của nguyên tử khi hình thành liên kết hóa học
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do:
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do: Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu).
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
Trong một nhóm A, bán kính nguyên tử của các nguyên tố: tăng theo chiều tăng của điện tích hạt nhân.
Độ âm điện đặc trưng cho khả năng
Độ âm điện đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
Các nguyên tố hóa học trong cùng một nhóm A có đặc điểm nào chung về cấu hình electron nguyên tử?
Các nguyên tố hóa học trong cùng một nhóm A có đặc điểm chung là có số electron hóa trị.
Các nguyên tố hóa học trong nhóm VIIIA có đặc điểm chung nào về cấu tạo nguyên tử trong các liệt kê sau:
Cấu tạo nguyên tử của các nguyên tố hóa học trong nhóm VIIIA có đặc điểm chung là : Lớp electron ngoài cùng đã điền đủ electron, bền vững.
Loại B vì He có cấu hình e là 1s2
Các nguyên tử của nhóm IA trong bảng tuần hoàn có đặc điểm chung nào về cấu hình electron mà quyết định tính chất của nhóm ?
Cấu hình electron chung của các nguyên tử nhóm IA là số electron lớp ngoài cùng bằng 1
Trong bảng hệ thống tuần hoàn, khi đi từ trái sang phải trong 1 chu kì thì
Trong bảng hệ thống tuần hoàn, khi đi từ trái sang phải trong 1 chu kì thì độ âm điện tăng dần.
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì độ âm điện giảm dần
Nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là
Nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là : Flo
Trong bảng HTTH, trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân thì bán kính nguyên tử
Trong bảng HTTH, trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Dãy sắp xếp các nguyên tử theo chiều tăng dần bán kính nguyên tử là
Nhận thấy các nguyên tố cùng thuộc chu kì 2, riêng Na thuộc chu kì 3 => bán kính nguyên tử của Na lớn nhất
F là phi kim mạnh nhất => có độ âm điện lớn nhất => bán kính nguyên tử nhỏ nhất
O là phi kim => có độ âm điện lớn hơn Li => bán kính của O nhỏ hơn Li
=> Dãy sắp xếp các nguyên tử theo chiều tăng dần bán kính nguyên tử là : F, O, Li, Na.
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
Y (Z = 8) là Oxi, thuộc chu kì 2 => có bán kính nguyên tử nhỏ nhất
X (Z = 12) là Mg và T (Z = 15) là P cùng thuộc chu kì 3 => P có độ âm điện lớn hơn Mg
=> bán kính Mg lớn hơn P (X > T)
R (Z = 19) là K thuộc chu kì 4 => R có bán kính nguyên tử lớn nhất
=> Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là : Y, T, X, R.

