Cho các thí nghiệm sau:
(1) Cho Mg vào dung dịch H2SO4 (loãng).
(2) Cho Fe3O4 vào dung dịch H2SO4 (loãng).
(3) Cho FeSO4 vào dung dịch H2SO4 (đặc, nóng).
(4) Cho Al(OH)3 vào dung dịch H2SO4 (đặc, nóng).
(5) Cho BaCl2 vào dung dịch H2SO4 (đặc, nóng).
(6) Cho Al(OH)3 vào dung dịch H2SO4 (loãng).
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là
Các thí nghiệm H2SO4 đóng vai trò chất oxi hóa là: (1) và (3)
Các phản ứng khác là các phản ứng trao đổi, không có sự thay đổi số oxi hóa nên không phải là phản ứng oxi hóa - khử.
Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trong thực tế, người ta sử dụng nước ozon để bảo quản trái cây. Ứng dụng trên dựa vào tính chất nào sau đây?
Ozon là chất oxi hóa mạnh có tác dụng oxi hóa hết các hợp chất, phá hủy cấu trúc của các vi sinh vật hoặc nấm, vi khuẩn làm cho trái cây, rau củ không bị hư hỏng.
Cho các phản ứng hóa học sau:
(a) S + O2 $\xrightarrow{{{t^ \circ }}}$ SO2
(b) S + 3F2 $\xrightarrow{{{t^ \circ }}}$ SF6
(c) S + Hg $\xrightarrow{{}}$ HgS
(d) S + 6HNO3 (đặc) $\xrightarrow{{{t^ \circ }}}$ H2SO4 + 6NO2 + 2H2O
Số phản ứng trong đó S thể hiện tính khử là :
\(\mathop S\limits^0 \;\; + \;\;{O_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 4} {O_2}\)
\(\mathop S\limits^0 \;\; + \;\;3{F_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 6} {F_6}\)
\(\mathop S\limits^0 \) + 6HNO3(đặc) \(\xrightarrow{{{t^o}}}\) \(\mathop{{H_2}S{O_4}}\limits^{ + 6} \) + 6NO2 + 2H2O
Trường hợp không xảy ra phản ứng hóa học là
Phản ứng B không xảy ra vì FeS tan trong axit HCl
FeS + 2HCl → FeCl2 + H2S
Thuốc thử nào dưới đây phân biệt được khí O2 với khí O3 bằng phương pháp hóa học?
O3 có tính oxi hóa mạnh hơn O2 nên có thể oxi hóa ${I^ - }$ thành I2 làm hồ tinh bột hóa xanh: ${O_3}\; + {\text{ }}2KI{\text{ }} + {\text{ }}{H_2}O\;\xrightarrow{{}}\;2KOH{\text{ }} + {\text{ }}{I_2}\; \downarrow + {\text{ }}{O_2} \uparrow .$
Khí X làm đục nước vôi trong và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy. Chất X là
Chất được dùng tẩy trắng giấy và bột giấy trong công nghiệp là SO2.
(SGK Hóa 10 NC tr 180)
SO2 luôn thể hiện tính khử trong các phản ứng với
SO2 luôn thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh như : O2, KMnO4, Br2,....
A Sai vì H2S có tính khử ${H_2}\mathop S\limits^{ - 2} \,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}\mathop S\limits^0 \,\, \downarrow \,\, + \,\,\,{H_2}O$
C Sai vì $2KOH\,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}{K_2}\mathop S\limits^{ + 4} {O_3}\,\,\, + \,\,\,{H_2}O$
$CaO\,\,\, + \,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}Ca\mathop S\limits^{ + 4} {O_3}$
B Sai vì $2NaOH\,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}N{a_2}\mathop S\limits^{ + 4} {O_3}\,\,\, + \,\,\,{H_2}O$
D Đúng vì:
PTHH : $2\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,{O_2}\underset{{{t^o}}}{\overset{{{V_2}{O_5}}}{\longleftrightarrow}}2\mathop S\limits^{ + 6} {O_3}\,$
$\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,B{r_2}\,\,\, + \,\,2{H_2}O\xrightarrow{{}}\,\,2HBr\,\,\, + \,\,\,{H_2}\mathop S\limits^{ + 6} {O_4}$
$5\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,\,2KMn{O_4}\,\,\, + \,\,\,2{H_2}O\xrightarrow{{}}\,\,{K_2}\mathop S\limits^{ + 6} {O_4}\,\, + \,\,2Mn\mathop S\limits^{ + 6} {O_4}\,\,\,\, + \,\,\,2{H_2}\mathop S\limits^{ + 6} {O_4}$
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
Hợp chất của chì có kết tủa màu đen là PbS $ \to $Trong khí thải nhà máy có chứa khí H2S.
PTHH : $Pb{(N{O_3})_2} + \,\,\,{H_2}S\xrightarrow{{}}PbS \downarrow \,\,\, + \,\,\,2HN{O_3}$
Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây?
A Sai vì Ag không phản ứng.
B Sai vì CuS không phản ứng.
C Sai vì NaCl và CuS không phản ứng.
D Đúng.
PTHH : $BaC{l_2}\,\,\,\, + \,\,\,\,{H_2}S{O_4}\xrightarrow{{}}\,\,BaS{O_4} \downarrow \,\,\, + \,\,\,2HCl$
$N{a_2}C{O_3}\,\,\, + \,\,\,{H_2}S{O_4}\xrightarrow{{}}\,\,N{a_2}S{O_4}\,\,\, + \,\,\,C{O_2} \uparrow \,\,\, + \,\,{H_2}O$
$FeS\,\,\, + \,\,\,\,{H_2}S{O_4}\xrightarrow{{}}FeS{O_4}\,\, + \,\,\,{H_2}S \uparrow $
Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C $\xrightarrow{{}}$ 2SO2$ \uparrow $ + CO2 $ \uparrow $+ 2H2O.
(b) H2SO4 + Fe(OH)2 $\xrightarrow{{}}$ FeSO4 + 2H2O.
(c) 4H2SO4 + 2FeO$\xrightarrow{{}}$ Fe2(SO4)3 + SO2 $ \uparrow $+ 4H2O.
(d) 6H2SO4 + 2Fe $\xrightarrow{{}}$ Fe2(SO4)3 + 3SO2 $ \uparrow $+ 6H2O.
Trong các phản ứng trên, phản ứng xảy ra với dung dịch H2SO4 loãng là
Phản ứng xảy ra với dung dịch H2SO4 loãng là phản ứng thể hiện tính axit (tác dụng với kim loại, bazơ, oxit bazơ, muối), kim loại không thể từ số oxi hóa thấp lên số oxi hóa cao nhất.
H2SO4 loãng không tác dụng với phi kim => Loại A
Ở đáp án C, D ta thấy Fe từ số oxi hóa 0 và +2 lên số oxi hóa +3 => Không thể là H2SO4 loãng
=> PTHH trong đó H2SO4 lloãng là:H2SO4 + Fe(OH)2 $\xrightarrow{{}}$ FeSO4 + 2H2O.
Trong nhóm VIA, đi từ O đến Te thì bán kính nguyên tử
Trong một nhóm, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng dần bán kính nguyên tử của các nguyên tố tăng. Chính vì thế tính oxi hóa của các nguyên tố giảm dần
Phản ứng nào sau đây không xảy ra?
A đúng : FeS + 2HCl $\xrightarrow{{}}$ FeCl2 + H2S.
B sai vì CuS không tan trong HCl
C đúng
D đúng
Dẫn từ từ đến dư khí H2S qua dung dịch X chứa NaCl, NH4Cl, CuCl2 và FeCl3 thu được kết tủa Y gồm
PTHH:
H2S + CuCl2 $\xrightarrow{{}}$ CuS↓ + 2HCl ;
2FeCl3 + H2S $\xrightarrow{{}}$ 2FeCl2 + 2HCl + S↓
→ Y gồm : CuS, S
Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là
$KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl\,\,\,\, + \,\,\,\frac{3}{2}{O_2} \uparrow $
$ \to {n_{{O_2}}} = \frac{3}{2}{n_{KCl{O_3}}} = \frac{3}{2} \cdot \frac{{100}}{{122,5}} \approx 1,224\,mol$
$2KMn{O_4}\xrightarrow{{{t^o}}}{K_2}Mn{O_4}\,\,\, + \,\,\,\,Mn{O_2}\,\,\,\, + \,\,\,{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{KMn{O_4}}} = \frac{1}{2} \cdot \frac{{100}}{{158}} \approx 0,316\,mol$
$KN{O_3}\xrightarrow{{{t^o}}}KN{O_2}\,\,\,\, + \,\,\,\frac{1}{2}{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{KN{O_3}}} = \frac{1}{2} \cdot \frac{{100}}{{101}} \approx 0,495mol$
$AgN{O_3}\xrightarrow{{{t^o}}}Ag\,\,\,\,\, + \,\,\,\,N{O_2}\,\,\,\, + \,\,\,\frac{1}{2}{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{AgN{O_3}}} = \frac{1}{2} \cdot \frac{{100}}{{170}} \approx 0,294mol$
Nhiệt phân 4,385 gam hỗn hợp X gồm KClO3 và KMnO4, thu được O2 và m gam chất rắn gồm K2MnO4, MnO2 và KCl. Toàn bộ lượng O2 tác dụng hết với cacbon nóng đỏ, thu được 0,896 lít hỗn hợp khí Y (đktc) có tỉ khối so với H2 là 16. Thành phần % theo khối lượng của KMnO4 trong X là
Hỗn hợp khí thu được gồm CO và CO2
Tỉ khối hơi hỗn hợp khí so với H2 là 16=> => Mhh = 32;
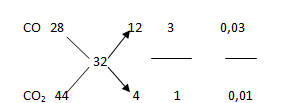
Bảo toàn nguyên tố O ta có : ${n_{{O_2}}} = \frac{1}{2}{n_{CO}} + {n_{C{O_2}}} = 0,015 + 0,01 = 0,025mol$
$KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl\,\,\,\, + \,\,\,\frac{3}{2}{O_2}$
$2KMn{O_4}\xrightarrow{{{t^o}}}{K_2}Mn{O_4}\,\,\, + \,\,\,\,Mn{O_2}\,\,\,\, + \,\,\,{O_2}$
Đặt ${n_{KCl{O_3}}} = a\,mol\,\,;\,\,\,{n_{KMn{O_4}}} = b\,\,mol$. Ta có:
$\left\{ \begin{gathered}122,5a + 158b = 4,385 \hfill \\1,5a + 0,5b = 0,025 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}a = 0,01 \hfill \\b = 0,02 \hfill \\\end{gathered} \right. \to \% {m_{KMn{O_4}}} =\frac{{0,02.158}}{{4,385}} \cdot 100\% = 72,06\% $
Chỉ từ các chất: Fe, S, dung dịch FeSO4 và dung dịch H2SO4 có thể có bao nhiêu phương pháp điều chế khí H2S bằng 2 phản ứng?
Cách 1:
(1) Fe + S $\xrightarrow{{{t^o}}}$ FeS
(2) FeS + H2SO4 $\xrightarrow{{}}$ FeSO4 + H2S↑
Cách 2:
(1) Fe + H2SO4 $\xrightarrow{{}}$ FeSO4 + H2↑
(2) S + H2 $\xrightarrow{{{t^o}}}$ H2S↑
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
$Fe,\,\,S\xrightarrow{{{t^0}}}\left\{ \begin{gathered}Fe \hfill \\S \hfill \\FeS \hfill \\\end{gathered} \right.\xrightarrow{{HCl}}\left\{ \begin{gathered}FeC{l_2} \hfill \\S \hfill \\{H_2}\,,\,\,{H_2}S\,\,(Z) \hfill \\\end{gathered} \right.$
Ta có: $\frac{{{n_{{H_2}}}}}{{{n_{{H_2}S}}}} = \frac{{34 - 10}}{{10 - 2}} = 3 \to {n_{{H_2}}} = 3{n_{{H_2}S}}$
Ta thấy ${n_{{H_2}S}} < {n_{{H_2}}} \Leftrightarrow {n_{FeS}} < {n_{Fe}}$dư $ \to $ Hiệu suất của phản ứng tính theo lưu huỳnh.
$ \to {n_{Fe}}$dư$ = {n_{Fe}} - {n_{FeS}} = a - 0,5b\,\,(1)$
Mà ${n_{Fe}}$dư$ = 3{n_{FeS}} = 3.0,5b = 1,5b\,\,\,(2)$
Từ (1) và (2) $ \to a - 0,5b = 1,5b \to a = 2b \to \frac{a}{b} = \frac{2}{1}$
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là
${n_{Fe}} = \frac{{5,6}}{{56}} = 0,1\,mol\,\,;\,\,{n_S} = \frac{{2,4}}{{32}} = 0,075\,mol$
Ta có sơ đồ phản ứng :
$Fe,\,\,S\xrightarrow{{{t^0}}}\left\{ \begin{gathered}Fe \hfill \\S \hfill \\FeS \hfill \\\end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered}FeC{l_2} \hfill \\S\,\,(G) \hfill \\{H_2}\,,\,\,{H_2}S\,\,(X) \hfill \\\end{gathered} \right.\xrightarrow{{ + {O_2}}}\left\{ \begin{gathered}S{O_2} \hfill \\{H_2}O \hfill \\\end{gathered} \right.$
Hỗn hợp khí X thu được gồm H2 , H2S. Chất rắn G là S dư.
Ta thấy từ đầu đến cuối quá trình chỉ có Fe, S, O2 bị thay đổi số oxi hóa Sử dụng bảo toàn electron cho Fe, S, O2
\(Fe \to F{e^{2 + }} + 2e\,\,\,\, {O_2} + 4e \to 2{O^{2 - }}\)
\(\mathop {{\text{ }}S}\limits^0 \to \mathop {{\text{ }}S}\limits^{ + 4} + 4e\)
\( \to {n_{{O_2}}} = \frac{{2.{n_{Fe}} + 4.{n_S}}}{4} = \frac{{2.0,1 + 4.0,075}}{4} = 0,125{\mkern 1mu} mol\)
\( \to {V_{{O_2}}} = 0,125.22,4 = 2,8{\mkern 1mu} (l)\)
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M . Giá trị của V là
${n_{{H_2}S{O_4}.3S{O_3}}} = \frac{{1,69}}{{338}} = {5.10^{ - 3}}mol$
$\begin{gathered}{H_2}S{O_4}.3S{O_3}\,\,\, + \,\,\,3{H_2}O\xrightarrow{{}}4{H_2}S{O_4} \hfill \\{5.10^{ - 3}}\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,02 \hfill \\\end{gathered} $
${H_2}S{O_4}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} + {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} 2KOH \to {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {K_2}S{O_4}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} + {\mkern 1mu} {\mkern 1mu} 2{H_2}O{\rm{ }}$
0,02 →0,04
$ \to {V_{KOH}} = \frac{{0,04}}{1} \cdot 1000 = 40\,ml$
Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 ml dung dịch X. Để trung hoà 100ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Phần trăm về khối lượng của nguyên tố lưu huỳnh trong oleum trên là
Gọi CT của oleum là H2SO4.nSO3
${n_{NaOH}} = 0,2.0,15 = 0,03\,mol$ (trong 100ml dd X)
${{H}_{2}}S{{O}_{4}}.nS{{O}_{3}}\xrightarrow{+n{{H}_{2}}O}(n+1){{H}_{2}}S{{O}_{4}}+2(n+1)NaOH\to (n+1)N{{a}_{2}}S{{O}_{4}}$
0,0075 0,03
$\begin{gathered}\to \frac{{n + 1}}{1} = \frac{{0,03}}{{0,015}} = 2 \to n = 1 \to oleum:\,{H_2}S{O_4}.S{O_3} \hfill \\\to \% {m_S} = \frac{{32.2}}{{98 + 80}} \cdot 100\% = 35,95\% \hfill \\\end{gathered} $

