Hoà tan 15,4 gam hỗn hợp Zn, Mg bằng một lượng vừa đủ dd HCl thu được 6,72 lít khí H2 (đktc) và dung dịch C. Tính khối lượng muối có trong dung dịch C: (Zn=65; Mg=24; Cl=35,5; H=1)
nH2 = 6,72 : 22,4 = 0,3 mol
Đặt số mol của Zn và Mg lần lượt là x và y (mol).
PTHH:
Zn + 2HCl → ZnCl2 + H2
x x x (mol)
Mg + 2HCl → MgCl2 + H2
y y y (mol)
- Khối lượng hỗn hợp kim loại: 65x + 24y = 15,4 (1)
- Số mol H2: x + y = 0,3 (2)
Giải (1) và (2) được x = 0,2 và y = 0,1
Dung dịch C chứa các muối: ZnCl2 (0,2 mol) và MgCl2 (0,1 mol)
=> m muối = 0,2.136 + 0,1.95 = 36,7 gam
Hòa tan hoàn toàn 20,0 gam hỗn hợp hai kim loại đều đứng trước hiđro trong dãy hoạt động hóa học trong dung dịch HCl dư thấy thoát ra 4,48 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
nH2 = 0,2 mol
BTNT “H”: nHCl = 2nH2 = 0,4 mol
BTKL: m muối = m KL + mHCl – mH2 = 20 + 0,4.36,5 – 0,2.2 = 34,2 gam
Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là
X{Mg, Al} + {Cl2, O2} → Z
Áp dụng định luật BTKL: mCl2 + mO2 = mZ – mX = 19,7 – 7,8 = 11,9 gam
Theo đề bài ta có hệ phương trình:
\(\left\{ \begin{array}{l}
{n_{C{l_2}}} + {n_{{O_2}}} = \dfrac{{5,6}}{{22,4}} = 0,25\\
71{n_{C{l_2}}} + 32{n_{{O_2}}} = 11,9
\end{array} \right. \to \left\{ \begin{array}{l}
{n_{C{l_2}}} = 0,1\\
{n_{{O_2}}} = 0,15
\end{array} \right.\)
Đặt số mol của Mg và Al lần lượt là x và y (mol)
- Khối lượng hỗn hợp: 24x + 27y = 7,8 (1)
- Bảo toàn e: 2nMg + 3nAl = 2nCl2 + 4nO2 => 2x + 3y = 0,1.2 + 0,15.4 hay 2x + 3y = 0,8 (2)
Giải (1) và (2) thu được x = 0,1 và y = 0,2
=> %mAl = 0,2.27/7,8 = 69,23%
Giả sử calcium oxalate kết tủa từ 1 ml máu tác dụng vừa hết với 2,05 ml dung dịch KMnO4 4,88.10-4 M. Nồng độ Ca2+ trong máu người đó theo đơn vị mg Ca2+ /100 ml máu là
\({n_{KMn{O_4}}} = 4,{88.10^{ - 4}}.\dfrac{{2,05}}{{1000}} = {10^{ - 6}}(mol)\)
Trong 1 ml máu:
\(\begin{array}{*{20}{c}}{5Ca{C_2}{O_4}}\\{2,{{5.10}^{ - 6}}}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{2KMn{O_4}}\\{{{10}^{ - 6}}}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{8{H_2}S{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{2MnS{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{5CaS{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{{K_2}S{O_4}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{10C{O_2}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{8{H_2}O}\\{}\end{array}\)
⇒ Khối lượng theo mg Ca2+ trong 1 ml máu là: 2,5.10-6.128.1000 = 0,32 mg
⇒ Khối lượng theo mg Ca2+ trong 100 ml máu là: 0,32.100 = 32 mg
Nồng độ Ca2+ trong máu người đó theo đơn vị mg Ca2+ /100 ml máu là 32 mg
Tổng các hệ số cân bằng phương trình trên là
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\(Ca{\mathop C\limits^{ + 3} _2}{O_4} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_4} \to \mathop {Mn}\limits^{ + 2} S{O_4} + CaS{O_4} + {K_2}S{O_4} + \mathop C\limits^{ + 4} {O_2} + {H_2}O\)
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop {2C}\limits^{ + 3} + 2e \to \mathop {2C}\limits^{ + 4} }\\{\mathop {Mn}\limits^{ + 7} \to \mathop {Mn}\limits^{ + 2} + 5e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
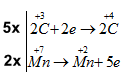
Bước 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(5Ca{C_2}{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 2MnS{O_4} + 5CaS{O_4} + {K_2}S{O_4} + 10C{O_2} + 8{H_2}O\)
Tổng các hệ số cân bằng phương trình trên là 5 + 2 + 8 + 2 + 5 + 1 + 10 + 8 = 41
Hòa tan hoàn toàn m gam Al trong dung dịch H2SO4 loãng dư thu được 3,36 lít khí H2 (đktc). Xác định khối lượng m
nH2 = 0,15 mol
Xét quá trình nhận e:
+) \(2\mathop H\limits^{ + 1} \,\, + \,\,2{\rm{e}}\,\, \to \,\,{H_2}\)
0,3 ← 0,15
Bảo toàn e: ne nhận = ne cho = 0,3 mol
Xét quá trình cho e:
+) \(\mathop {Al}\limits^0 \,\, \to \,\,\mathop {Al}\limits^{ + 3} \,\, + 3{\rm{e}}\)
0,1 ← 0,3
=> mAl = 0,1 . 27 = 2,7 (g)
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 là sản phẩm khử duy nhất (đktc). Giá trị của V là
nMg = 0,1 mol
Mg phản ứng với HNO3 tạo muối Mg2+
Xét quá trình cho – nhận e:
\(\begin{array}{l}2{N^{ + 5}} + 10{\rm{e}} \to {N_2}\,\,\,\,\,\,\,\,\,\,Mg \to M{g^{ + 2}} + 2{\rm{e}}\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\,\, \to 0,02\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,0,2\end{array}\)
=> VN2 = 0,02.22,4 = 0,448 lít
Hòa tan hoàn toàn 2,16 gam kim loại M hóa trị III bởi lượng dư dung dịch H2SO4 đặc, nóng thu được 2,688 lít khí SO2 (là sản phẩm khử duy nhất). M là
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
\(\begin{array}{l}M \to \mathop M\limits^{ + 3} + 3{\rm{e}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop S\limits^{ + 6} \,\,\, + \,\,\,2{\rm{e}} \to \mathop S\limits^{ + 4} \\0,08\,\,\,\, \leftarrow \,\,\,\,0,24\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ }}0,24 \leftarrow \,0,12\end{array}\)
\( = > {\rm{ }}{n_M} = 0,08{\rm{ }}mol = > {M_M} = \dfrac{{2,16}}{{0,08}} = 27\)
=> M là kim loại Al
Hòa tan hết 9,6 gam kim loại M trong dung dịch H2SO4 đặc, nóng, thu được SO2 là sản phẩm khử duy nhất. Cho toàn bộ lượng SO2 này hấp thụ hết vào 0,5 lít dung dịch NaOH 0,6M, sau phản ứng đem cô cạn dung dịch được 18,9 gam chất rắn. Kim loại M đó là
nNaOH = 0,3 (mol)
mchất rắn = \({{\rm{m}}_{{\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{3}}}}}\)= 18,9 (g) => \({\rm{S}}{{\rm{O}}_2}{\rm{ + 2NaOH }} \to {\rm{ N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_3} + {\rm{ }}{{\rm{H}}_2}{\rm{O}}\)
0,15 ← 0,3
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
\(\begin{array}{l}M \to \mathop M\limits^{ + n} + n{\rm{e}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop S\limits^{ + 6} \,\,\, + \,\,\,2{\rm{e}} \to \mathop S\limits^{ + 4} \\\dfrac{{0,3}}{n}\,\,\,\, \leftarrow \,\,\,\,0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ }}0,3\,\, \leftarrow \,\,0,15\end{array}\)
\( + ){\rm{ }}{M_M} = \dfrac{{{m_M}}}{{{n_M}}} = \dfrac{{9,6}}{{\dfrac{{0,3}}{n}}} = 32n \Rightarrow n = 2;M = 64\)
=> M là kim loại Cu
Cho 9,2 gam hỗn hợp gồm Zn và Al phản ứng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng thu được 5,6 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Khối lượng Al có trong hỗn hợp là
\({n_{S{O_2}}} = 0,25\,\,mol\)
Gọi số mol Zn và Al lần lượt là x và y mol => mhỗn hợp = 65x + 27y = 9,2 (1)
Xét quá trình cho – nhận e:
\(\begin{array}{l}Mg \to \mathop {Mg}\limits^{ + 2} + 2{\rm{e}}\,\,\,\,\,\,\,\,\,\,\,\,\mathop S\limits^{ + 6} + 2{\rm{e}} \to \mathop S\limits^{ + 4} \\\,\,x\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,2{\rm{x}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,5\, \leftarrow \,{\rm{0,25}}\\Al \to \mathop {Al}\limits^{ + 3} + 3{\rm{e}}\\\,y\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,3y\end{array}\)
+) Bảo toàn e: ne cho = ne nhận => 2x + 3y = 0,5 (2)
Từ (1) và (2) ta có hệ: \(\left\{ \begin{array}{l}{\rm{65x}} + 27y = 9,2\\2{\rm{x}} + 3y = 0,5\end{array} \right. = > \left\{ \begin{array}{l}x = 0,1\\y = 0,1\end{array} \right.\)
=> nAl = 0,1 mol => mAl = 2,7 (g)
Ngâm thanh Fe vào dung dịch chứa 0,03 mol Cu(NO3)2 một thời gian, lấy thanh kim loại ra thấy trong dung dịch chỉ còn chứa 0,01 mol Cu(NO3)2. Giả sử kim loại sinh ra bám hết vào thanh Fe. Hỏi khối lượng thanh Fe tăng hay giảm bao nhiêu gam ?
Xét quá trình phản ứng có Fe cho e và Cu2+ nhận e
\(\mathop {Cu}\limits^{ + 2} \,\,\,\, + \,\,\,\,2{\rm{e}}\,\,\,\,\, \to \,\,\,\,Cu\)
0,02 → 0,04 → 0,02
\(\mathop {Fe}\limits^{} \,\,\, \to \mathop {Fe}\limits^{ + 2} \,\,\, + \,\,\,\,2{\rm{e}}\)
0,02 ← 0,04
+) ∆mthanh Fe = mCu sinh ra – mFe phản ứng = 0,02.64 – 0,02.56 = 0,16 gam
=> khối lượng thanh Fe tăng 0,16 gam
Hòa tan 25 gam muối CuSO4.5H2O vào nước được 500 ml dung dịch. Cho dần mạt sắt vào 50 ml dung dịch trên, khuấy nhẹ cho đến khi hết màu xanh. Khối lượng chất rắn thu được sau phản ứng tăng hau giảm bao nhiêu gam ?
\({n_{C{u^{2 + }}}} = 0,1\left( {mol} \right) \Rightarrow {n_{C{u^{2 + }}trong50ml}} = 0,01\left( {mol} \right)\)
Xét quá trình phản ứng có Fe cho e và Cu2+ nhận e
\(\mathop {Cu}\limits^{ + 2} \,\,\,\, + \,\,\,\,2{\rm{e}}\,\,\,\,\, \to \,\,\,\,Cu\)
0,01 → 0,02 → 0,01
\(\mathop {Fe}\limits^{} \,\,\, \to \mathop {Fe}\limits^{ + 2} \,\,\, + \,\,\,\,2{\rm{e}}\)
0,01 ← 0,02
=> ∆mchất rắn = mCu sinh ra – mFe phản ứng = 0,01.64 – 0,01.56 = 0,08 gam
=> khối chất rắn tăng 0,08 gam
Nhúng một thanh sắt vào dung dịch Cu(NO3)2 một thời gian thấy khối lượng sắt tăng 0,8 gam. Khối lượng sắt đã tham gia phản ứng là
Xét quá trình phản ứng có Fe cho e và Cu2+ nhận e
\(Fe\,\,\, \to \mathop {Fe}\limits^{ + 2} \,\,\, + \,\,\,\,2{\rm{e}}\)
x → 2x
\(\mathop {Cu}\limits^{ + 2} \,\,\,\, + \,\,\,\,2{\rm{e}}\,\,\,\,\, \to \,\,\,\,Cu\)
2x → x
∆mthanh Fe = mCu sinh ra – mFe phản ứng = 64x – 56x = 8x = 0,8 (g) => x = 0,1 (mol)
=> mFe = 0,1.56 = 5,6 gam
Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm Cu(NO3)2, H2SO4, NO và H2O thì số electron mà 1 mol Cu2S đã nhường là
Xét quá trình cho e:
\(Cu{{\rm{S}}_2}\,\, \to \,\,\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + 2{H_2}\mathop S\limits^{ + 4} {O_4} + 10{\rm{e}}\)
=> 1 mol CuS2 nhường 10e
Cho 8,654 gam hỗn hợp khí Cl2 và O2 tác dụng vừa đủ với 0,396 mol hỗn hợp Y gồm Mg, Zn, Al thì thu được 23,246 gam hỗn hợp muối clorua và oxit của 3 kim loại. Cho Z phản ứng vừa đủ với V ml dung dịch HCl 1M thì thu được dung dịch T. Cho từ từ dung dịch Ba(OH)2 2M vào T đến khi lượng kết tủa thu được không thay đổi về khối lượng thì cần vừa đủ 286 ml. Giá trị của V là
\({{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,572}}\left( {{\rm{mol}}} \right) \Rightarrow {{\rm{n}}_{{\rm{O}}{{\rm{H}}^ - }}} = 1,144\left( {{\rm{mol}}} \right)\)
Gọi số mol Mg, Zn và Al lần lượt là x, y và z mol => nhỗn hợp Y = x + y + z = 0,396 (1)
Áp dụng định luật bảo toàn khối lượng: mhỗn hợp Y = 23,246 – 8,654 = 14,592 => 24x + 65y + 27z = 14,592 (2)
Z phản ứng với HCl được dung dịch T gồm Mg2+, Zn2+, Al3+. Cho T tác dụng với Ba(OH)2 đến khối lượng kết tủa không đổi => 2x + 4y + 4z = 1,144 (3)
Từ (1), (2) và (3) \( \Rightarrow \left\{ \begin{array}{l}{\rm{x = 0,22}}\\{\rm{y = 0,12}}\\{\rm{z = 0,056}}\end{array} \right.\)
Bảo toàn điện tích: \({{\rm{n}}_{{\rm{HCl}}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{l}}^{\rm{ - }}}}}{\rm{ = 2}}{{\rm{n}}_{{\rm{M}}{{\rm{g}}^{{\rm{2 + }}}}}}{\rm{ + 2}}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ + 3}}{{\rm{n}}_{{\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}}} = 2.0,22 + 2.0,12 + 3.0,056 = 0,848\)
=> VHCl = 848 ml
Chia 29,8 gam hỗn hợp X gồm Mg, Na, K và Ca thành 2 phần bằng nhau. Phần 1 tác dụng hoàn toàn với dung dịch HNO3 loãng thu được 1,568 lít khí N2 duy nhất (đktc) và dung dịch chứa x gam muối (không chứa NH4NO3). Phần 2 tác dụng hoàn toàn với oxi thu được y gam hỗn hợp 4 oxit. Giá trị của x, y là
nN2 = 0,07 mol
Phần 1 và phần 2 như nhau nên số mol e cho và nhận là như nhau
Phần 1: ne cho = ne nhận = 10nN2 = 0,7
BT điện tích: \({{\rm{n}}_{{\rm{NO}}_{\rm{3}}^{\rm{ - }}}}{\rm{ = }}{{\rm{n}}_{{\rm{e cho}}}} = 0,7\) => x = mmuối = mKL + \({{\rm{m}}_{{\rm{NO}}_{\rm{3}}^{\rm{ - }}}}\)= 14,9 + 62.0,7 = 58,3 (g)
Phần 2: ne cho = ne nhận = 10nN2 = 2nO => nO = 0,35
=> BTKL: y = moxit = mKL + mO = + 0,35.16 = 20,5 (g)
Chia 47,1 gam hỗn hợp X gồm Mg, Al, Zn, Ni thành 2 phần bằng nhau. Phần 1 tác dụng hoàn toàn với dung dịch HNO3 vừa đủ thu được 7,84 lít khí NO duy nhất (đktc) và dung dịch Y chứa x gam muối (không chứa NH4NO3). Nếu cho Y tác dụng với dung dịch NaOH thì lượng kết tủa lớn nhất thu được là y gam. Phần 2 tác dụng hoàn toàn với dung dịch HCl thu được V lít khí H2 (đktc). Giá trị của y là
nNO = 0,35 mol
Phần 1 và phần 2 như nhau nên số mol e cho và nhận là như nhau
Phần 1: ne cho = ne nhận = 3nN2 = 1,05 mol
Dung dịch Y tác dụng NaOH thu được kết tủa lớn nhất
=> BT điện tích: \({{\rm{n}}_{{\rm{O}}{{\rm{H}}^ - }}}{\rm{ = }}{{\rm{n}}_{{\rm{e cho}}}} = 1,05{\rm{ mol}}\) => y = mkết tủa = mKL + \({{\rm{m}}_{{\rm{O}}{{\rm{H}}^ - }}}\)= 23,55 + 1,05.17 = 41,4 gam
Cho phương trình phản ứng
\(aFeS{O_4} + b{K_2}C{{\rm{r}}_2}{O_7} + c{H_2}S{O_4} \to dF{{\rm{e}}_2}{(S{O_4})_3} + e{K_2}S{O_4} + fC{{\rm{r}}_2}{(S{O_4})_3} + g{H_2}O\)
Tỷ lệ a : b là
\(\left. \begin{array}{l}3 \times \\\mathop 1\limits^{} \times \end{array} \right|\left| \begin{array}{l}2\mathop {{\rm{Fe}}}\limits^{ + 2} \to 2\mathop {{\rm{Fe}}}\limits^{ + 3} {\rm{ + 2e}}\\2\mathop {{\rm{Cr}}}\limits^{ + 6} {\rm{ + 6e }} \to {\rm{ 2}}\mathop {{\rm{Cr}}}\limits^{ + 3} \end{array} \right.\)
\(6FeS{O_4} + {K_2}C{{\rm{r}}_2}{O_7} + 7{H_2}S{O_4} \to 3F{{\rm{e}}_2}{(S{O_4})_3} + {K_2}S{O_4} + C{{\rm{r}}_2}{(S{O_4})_3} + 7{H_2}O\)
=> tỉ lệ a : b = 6 : 1
Cho 15,2 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 8,96 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 39,7 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 15,2 gam X là
Đặt nCl2 = x; nO2 = y (mol)
BTKL: mY= mZ – mX = 39,7 – 15,2 = 24,5 (g)
Ta có hệ:
\(\left\{ \begin{gathered}
x + y = 0,4 \hfill \\
71x + 32y = 24,5 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,3 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right.\)
Đặt nMg = a; nCa = b (mol)
Ta có hệ:
\(\left\{ \begin{gathered}
{m_{Mg}} + {m_{Ca}} = {m_X} \hfill \\
\xrightarrow{{BT:e}}2{n_{Mg}} + 2{n_{Ca}} = 2{n_{C{l_2}}} + 4{n_{{O_2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
24a + 40b = 15,2 \hfill \\
2a + 2b = 2.0,3 + 4.0,1 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
a = 0,3 \hfill \\
b = 0,2 \hfill \\
\end{gathered} \right.\)
=> mMg = 0,3.24 = 7,2 (g)
Cho 1,35 gam kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thu được 1,85925 lít khí SO2 (ở 25oC, 1 bar). Kim loại M là
Ta có \({n_{S{O_2}}} = \dfrac{{1,85925}}{{24,79}} = 0,075mol\)
Ta có phản ứng xảy ra theo sơ đồ sau: \(M + {H_2}S{O_4} \to {M_2}{(S{O_4})_n} + S{O_2} + {H_2}O\)
Nhận thấy các nguyên tử bị thay đổi số oxi hóa là M và S
\(\begin{array}{*{20}{c}}{1x}\\{\mathop {\mathop {nx}\limits^{} }\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {2M}\limits^0 \to \mathop {{M_2}}\limits^{ + n} + 2ne}\\{\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} }\end{array}} \right.\)
=> Phương trình cân bằng là: \(2M + 2n{H_2}S{O_4} \to {M_2}{(S{O_4})_n} + nS{O_2} + 2n{H_2}O\)
Tính toán theo PTHH => \({n_M} = \dfrac{{0,075.2}}{n} = \dfrac{{0,15}}{n}(mol) = \dfrac{{1,35}}{M} = > M = 9n\)
Ta thấy n=3 => M=27 => M là Al thỏa mãn

