Hòa tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
Cách 1:
\(F{\rm{e}} + {H_2}S{O_4} \to F{\rm{eS}}{{\rm{O}}_4} + {H_2}\)
0,1 \( \to \) 0,1 (mol)
\(10F{\rm{eS}}{{\rm{O}}_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{{\rm{e}}_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O\)
0,1 \( \to \) 0,02 (mol)
Cách 2:
\(F\text{e}\xrightarrow{{{H}_{2}}S{{O}_{4\,\,loang}}}F{{e}^{+2}}\xrightarrow{KMn{{O}_{4}}}F{{\text{e}}^{+3}}\)
\(\begin{array}{l}\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1{\rm{e}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop {Mn}\limits^{ + 7} \,\,\, + \,\,\,5{\rm{e}} \to \mathop {Mn}\limits^{ + 2} \\0,1\,\,\,\, \to \,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ }}0,1\,\, \to \,\,0,02\end{array}\)
=> V dd KMnO4 = 0,02 : 0,5 = 0,04 lít = 40 ml
Cho 2,24 gam kim loại X tác dụng với dung dịch sulfuric acid đặc, nóng, dư thu được 1,4874 lít khí SO2 (ở 25oC, 1 bar) và muối X2(SO4)3. X là
Sơ đồ phản ứng: \(X + {H_2}S{O_4} \to {X_2}{(S{O_4})_3} + S{O_2} + {H_2}O\)
\(\begin{array}{*{20}{c}}{1x}\\{\mathop {\mathop {3x}\limits^{} }\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{2\mathop X\limits^0 + 6e \to \mathop {{X_2}}\limits^{ + 3} }\\{\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} }\end{array}} \right.\)
=> Phương trình cân bằng là: \(2X + 6{H_2}S{O_4} \to {X_2}{(S{O_4})_3} + 3S{O_2} + 6{H_2}O\)
Theo phương trình, ta có: \({n_{S{O_2}}} = \dfrac{{1,4874}}{{24,79}} = 0,06(mol)\)
Tính toán theo phương trình => \({n_X} = \dfrac{{0,06.2}}{3} = 0,04(mol) = \dfrac{{2,24}}{{{M_X}}} = > {M_X} = 56 = > \)X là Fe
Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 18,12 gam manganese (II) sulfate (MnSO4), I2 và K2SO4. Khối lượng iodine (I2) đã tạo thành là
Sơ đồ phản ứng: \(KI + KMn{O_4} + {H_2}S{O_4} \to MnS{O_4} + {I_2} + {K_2}S{O_4} + {H_2}O\)
\(\begin{array}{*{20}{c}}{5x}\\{\mathop {\mathop {2x}\limits^{} }\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{2\mathop I\limits^{ - 1} \to \mathop {{I_2}}\limits^0 + 2e}\\{\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} }\end{array}} \right.\)
=> Phương trình cân bằng là: \(10KI + 2KMn{O_4} + 8{H_2}S{O_4} \to 2MnS{O_4} + 5{I_2} + 6{K_2}S{O_4} + 8{H_2}O\)
Theo đề bài ta có: \({n_{MnS{O_4}}} = \dfrac{{18,12}}{{151}} = 0,12(mol)\)
Tính toán theo PTHH => \({n_{{I_2}}} = \dfrac{{0,12.5}}{2} = 0,3(mol) = > {m_{{I_2}}} = 76,2gam\)
Cho 11,2 gam Fe tác dụng hoàn toàn với dung dịch H2SO4 loãng. Thể tích khí H2 thu được ở đktc là
nFe = 0,2 mol
Xét quá trình cho e:
$\overset{0}{\mathop{F\text{e}}}\,\,\,\to \,\,\overset{+2}{\mathop{F\text{e}}}\,\,\,+2\text{e}$
0,2 → 0,4
Bảo toàn e: ne nhận = ne cho = 0,4 mol
Xét quá trình nhận e:
$2\overset{+1}{\mathop{H}}\,\,\,+\,\,2\text{e}\,\,\to \,\,{{H}_{2}}$
0,4 → 0,2
=> VH2 = 0,2.22,4 = 4,48 lít
Thể tích khí Cl2 (đktc) cần dùng để phản ứng vừa hết với 5,6 gam Fe là
nFe = 0,1 mol
Cl2 phản ứng với Fe tạo muối Fe3+
Xét quá trình cho – nhận e:
$\begin{align} & C{{l}_{2}}\,\,\,+\,\,\,2\text{e}\to 2\overset{-1}{\mathop{Cl}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,F\text{e}\to\overset{+3}{\mathop{F\text{e}}}\,+3\text{e} \\ & 0,15\,\leftarrow \,0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\to \,\,\,\,0,3 \\ \end{align}$
=> VCl2 = 0,15.22,4 = 3,36 lít
Cho 2,4 gam một kim loại tác dụng với lượng khí clo vừa đủ sau phản ứng thu được 9,5 gam một chất có công thức là MCl2. Kim loại M là
Bảo toàn khối lượng: ${{m}_{M}}+{{m}_{C{{l}_{2}}}}={{m}_{MC{{l}_{2}}}}=>\,\,{{m}_{C{{l}_{2}}}}=9,5-2,4=7,1\,\,gam\,\,=>{{n}_{C{{l}_{2}}}}=0,1\,\,mol$
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
$\begin{align} & M\to \overset{+2}{\mathop{M}}\,+2\text{e}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,C{{l}_{2}}\,\,\,+\,\,\,2\text{e}\to2\overset{-1}{\mathop{Cl}}\, \\ & 0,1\,\,\,\,\leftarrow \,\,\,\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\to \,\,\,0,2 \\ \end{align}$
$=>\text{ }{{n}_{M}}=0,1\text{ }mol=>{{M}_{M}}=\frac{2,4}{0,1}=24$
=> M là kim loại Mg
Đốt 13 gam bột kim loại R hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam (giả sử hiệu suất phản ứng là 100%). Kim loại R là
Bảo toàn khối lượng: ${{m}_{R}}+{{m}_{{{O}_{2}}}}={{m}_{oxit}}\,\,=>{{m}_{{{O}_{2}}}}=16,2-13=3,2\,\,gam\,\,=>\,\,{{n}_{{{O}_{2}}}}=0,1\,\,mol$
Xét quá trình cho – nhận e và áp dụng bảo toàn e:
$\begin{align} & R\to \overset{+2}{\mathop{R}}\,+2\text{e}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{O}_{2}}\,\,\,+\,\,\,4\text{e}\to2\overset{-2}{\mathop{O}}\, \\ & 0,2\,\,\,\,\leftarrow \,\,\,\,0,4\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\to \,\,0,4 \\ \end{align}$
$=>\text{ }{{n}_{R}}=0,2\text{ }mol=>{{M}_{R}}=\frac{13}{0,2}=65$
=> R là kim loại Zn
Cho 5 gam hỗn hợp Mg và Zn tác dụng hết với dung dịch HCl, thấy thoát ra 3,136 lít khí H2 (đktc). Số mol Mg có trong hỗn hợp ban đầu là
Gọi số mol Mg và Zn lần lượt là x và y mol
=> mhỗn hợp = 24x + 65y = 5 (1)
Xét quá trình cho – nhận e:
$\begin{align} & Mg\to \overset{+2}{\mathop{Mg}}\,+2\text{e}\,\,\,\,\,\,\,\,\,\,\,\,2\,\overset{+1}{\mathop{H}}\,+2\text{e}\to {{H}_{2}} \\ & \,\,x\,\,\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,\,\,\,2\text{x}\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,28\,\leftarrow \,\,\,\,\,\,\text{0,14} \\ & Zn\to \overset{+2}{\mathop{Zn}}\,+2\text{e} \\ & \,y\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,\,\,\,\,2y \\ \end{align}$
Bảo toàn e: ne cho = ne nhận => 2x + 2y = 0,28 (2)∆
Từ (1) và (2) ta có hệ: $\left\{ \begin{gathered} 24{\text{x}} + 65y = 5 \hfill \\ 2{\text{x}} + 2y = 0,28 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered} x = 0,1 \hfill \\ y = 0,04 \hfill \\ \end{gathered} \right.$
=> nMg = 0,1 mol
Ngâm một thanh Zn dư trong 100 ml dung dịch AgNO3 0,1M. Khi các phản ứng xảy ra hoàn toàn thì khối lượng thanh Zn
Xét quá trình phản ứng có Zn cho e và Ag+ nhận e
$\overset{+1}{\mathop{Ag}}\,\,\,\,\,+\,\,\,\,1\text{e}\,\,\,\,\,\to \,\,\,\,Ag$
0,01 → 0,01 → 0,01
$\overset{{}}{\mathop{Zn}}\,\,\,\,\to \overset{+2}{\mathop{Zn}}\,\,\,\,+\,\,\,\,2\text{e}$
0,005 ← 0,01
=> ∆mthanh Zn = mAg sinh ra – mZn phản ứng = 0,01.108 – 0,005.65 = 0,755 gam
=> khối lượng thanh Zn tăng 0,755 gam
Cho 6,4 gam bột Cu tác dụng hoàn toàn với dung dịch AgNO3 dư, sau khi phản ứng hoàn toàn thu được chất rắn có khối lượng là
nCu = 0,1 mol
Xét quá trình phản ứng có Cu cho e và Ag+ nhận e
$Cu\,\,\,\to \overset{+2}{\mathop{Cu}}\,\,\,\,+\,\,\,\,2\text{e}$
0,1 → 0,2
$\overset{+1}{\mathop{Ag}}\,\,\,\,\,\,\,+\,\,\,\,1\text{e}\,\,\,\,\,\,\to \,\,\,\,Ag$
0,2 → 0,2
Vì bột Cu phản ứng hoàn toàn trong AgNO3 dư => chất rắn sau phản ứng chỉ có Ag
=> mAg = 0,2.108 = 21,6 gam
Trong phản ứng đốt cháy CuFeS2 tạo ra các sản phẩm CuO, Fe2O3 và SO2 thì 1 phân tử CuFeS2 sẽ
\(\mathop {Cu}\limits^{} \mathop {Fe}\limits^{} \mathop {{S_2}}\limits^{} + {\text{ }}{O_2}\xrightarrow{{{t^o}}}\mathop {Cu}\limits^{ + 2} \mathop O\limits^{ - 2} {\text{ }} + {\text{ }}\mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} + {\text{ }}\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \)
Xét các quá trình trao đổi e:
\(2CuFe{S_2}\, \to \,\,2\mathop {Cu}\limits^{ + 2} \, + \,\mathop {2Fe}\limits^{ + 3} \, + \,\mathop {4S}\limits^{ + 4} \, + \,26e\)
\(\mathop {{O_2}}\limits^0 \, + \,4e\,\, \to \,\,2\mathop O\limits^{ - 2} \,\)
Rút gọn, ta có:
\(CuFe{S_2}\, \to \,\,\mathop {Cu}\limits^{ + 2} \, + \,\mathop {Fe}\limits^{ + 3} \, + \,\mathop {2S}\limits^{ + 4} \, + \,13e\)
\(\mathop {{O_2}}\limits^0 \, + \,4e\,\, \to \,\,2\mathop O\limits^{ - 2} \,\)
Vậy 1 phân tử CuFeS2 nhường 13e
Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
nkhí X = 0,35 mol
Gọi số mol của Cl2 và O2 lần lượt là x và y mol
=> nkhí X = x + y = 0,35 (1)
Bảo toàn khối lượng: mkhí X + mhh Y = mhh Z
=> mkhí X = 30,1 – 11,1 = 19 gam => 71x + 32y = 19 (2)
Từ (1) và (2) ta có hệ: $\left\{ \begin{gathered} x + y = 0,35 \hfill \\ 71{\text{x}} + 32y = 19 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered} x = 0,2 \hfill \\ y = 0,15 \hfill \\ \end{gathered} \right.$
Gọi số mol của Mg và Al trong hỗn hợp Y là a và b
=> mhh Y = 24a + 27b = 11,1 (3)
Xét quá trình cho – nhận e:
$\begin{align} & Mg\to \overset{+2}{\mathop{Mg}}\,+2\text{e}\,\,\,\,\,\,\,\,\,\,\,\,\,C{{l}_{2}}+2\text{e}\to 2\overset{1}{\mathop{Cl}}\, \\ & \,a\,\,\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,\,\,\,2a\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\to 0,4 \\ & Al\to \overset{+3}{\mathop{Al}}\,+3\text{e}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{\text{O}}_{2}}\,\,+\,\,\,4\text{e}\to\,\,2\overset{-2}{\mathop{\text{O}}}\, \\ & \,b\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,3b\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,15\to 0,6 \\ \end{align}$
Bảo toàn e: ne cho = ne nhận => 2a + 3b = 0,4 + 0,6 = 1 (4)
Từ (3) và (4) ta có hệ: $\left\{ \begin{gathered} 24{\text{a}} + 27b = 11,1 \hfill \\ 2{\text{a}} + 3b = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered} a = 0,35 \hfill \\ b = 0,1 \hfill \\ \end{gathered} \right.$
=>$\% {m_{Al}} = \frac{{0,1.27}}{{11,1}}.100\% = 24,32\% $
Hòa tan hoàn toàn 2,7 gam hỗn hợp X gồm Fe, Cr, Al bằng dung dịch HCl dư, thu được 1,568 lít khí H2 (đktc). Mặt khác, cho 2,7 gam X phản ứng hoàn toàn với khí Cl2 dư thu được 9,09 gam muối. Khối lượng Al trong 2,7 gam X là
Gọi số mol Fe, Cr và Al lần lượt là x, y và z mol
=> mhỗn hợp X = 56x + 52y + 27z = 2,7 (1)
TN1: nH2 = 0,07 mol
Tác dụng với HCl => Fe và Cr lên số oxi hóa +2
Bảo toàn e: ne cho = ne nhận => 2x + 2y + 3z = 0,07.2 (2)
TN2: tác dụng với khí Cl2 dư => tạo ra muối FeCl3 (x mol), CrCl3 (y mol) và AlCl3 (z mol)
=> mmuối = 162,5x + 158,5y + 133,5z = 9,09 (3)
Từ (1), (2) và (3) => x = 0,02 mol; y = 0,02 mol; z = 0,02 mol
=> mAl = 0,02.27 = 0,54 gam
Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
nH2 = 1,344 : 22,4 = 0,06 mol
BTNT “H”: nH2SO4 = nH2 = 0,06 mol
BTKL: m muối = mKL + mH2SO4 – mH2 = 3,22 + 0,06.98 – 0,06.2 = 8,98 gam
10,8g kim loại A hóa trị không đổi tác dụng hoàn toàn với 3,696 lít O2 đktc được rắn B. Cho B tác dụng hết với dd H2SO4 loãng thu được 2,688 lít khí đktc. Phát biểu nào sau đây đúng?
Gọi n là hóa trị của A
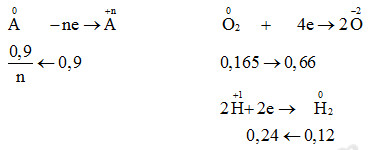
\({m_A} = {n_A}.{M_A} \to \dfrac{{0,9}}{n}.{M_A} = 10,8 \to {M_A} = 12n\)
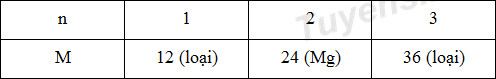
Xét các phương án:
Trong MgCl2: %mMg = 24/(24+35,5.2) = 25,26% => A sai
Hợp chất MgO là hợp chất ion => B sai
Công thức hidroxit là Mg(OH)2 và không tan trong nước => C đúng
Cấu hình e cùa Mg: 1s22s22p63s2 nên Mg thuộc chu kì 3 => D sai
Chia 22,0 g hỗn hợp X gồm Mg, Na và Ca thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với O2 thu được 15,8 g hỗn hợp 3 oxit. Phần 2 cho tác dụng với dung dịch HCl dư thu được V (lít) khí H2 (đktc). Giá trị của V là:
Phần 1 và phần 2 như nhau nên số mol e cho và nhận là như nhau.
Phần 1: BTKL ta có: mO = mOxit – mKL = 15,8 – 11 = 4,8 gam
=> nO = 4,8 : 16 = 0,3 mol
=> ne cho = ne nhận = 2nO = 0,3.2 = 0,6 mol
Phần 2: n e cho = n e nhận = 2nH2 => 2nH2 = 0,6 => nH2 = 0,3 mol
=> VH2 = 0,3.22,4 = 6,72 lít
Cho phản ứng: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
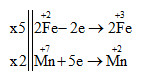
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Chất oxi hóa là KMnO4 có hệ số là 2
Chất khử là FeSO4 có hệ số là 10
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
Cách 1:
\(\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,225\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,0,225\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\
10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O \hfill \\
0,225\,\,\,\,\,\,\,\,\, \to 0,045(mol) \hfill \\
\end{gathered} \)
Cách 2:
\(Fe\xrightarrow{{{H_2}S{O_4}\,loang}}\mathop {Fe}\limits^{ + 2} \xrightarrow{{KMn{O_4}}}\mathop {Fe}\limits^{ + 3} \)
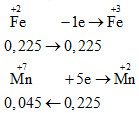
=> V dd KMnO4 = 0,045 : 0,5 = 0,09 lít = 90 ml
Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là
- Hỗn hợp khí có:
nkhí = 8,96 : 22,4 = 0,4 mol
Mkhí = 19.2 = 38
Đặt nNO = x mol và nNO2 = y mol
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{n_{khi}} = x + y = 0,4\\{m_{khi}} = 30{\rm{x}} + 46y = 0,4.38\end{array} \right. \to x = y = 0,2\)
- Quá trình trao đổi e:
Cu0 → Cu+2 + 2e N+5 + 3e → N+2 (NO)
0,4 ← (0,6+0,2) 0,6 ← 0,2
N+5 + 1e → N+4 (NO2)
0,2 ← 0,2
⟹ mCu = 0,4.64 = 25,6 gam
Hòa tan hoàn toàn một oxide kim loại FexOy vào dung dịch HNO3 dư thu được 2,479 lít khí NO (sản phẩm khử ở điều kiện 25oC, 1 bar) và dung dịch A. Cô cạn dung dịch A đươc 72,6 gam muối. Công thức của FexOy là
* Lập phương trình hóa học
\(F{e_x}{O_y} + {\rm{ }}HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + {\rm{ }}NO{\rm{ }} + {\rm{ }}{H_2}O\)
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\(\mathop {F{e_x}}\limits^{ + 2y/x} {O_y} + {\rm{ }}H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + {\rm{ }}\mathop N\limits^{ + 2} O{\rm{ }} + {\rm{ }}{H_2}O\)
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} }\\{\mathop {xFe}\limits^{ + 2y/x} \to \mathop {xFe}\limits^{ + 3} + (3x - 2y)e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
Bước 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(3F{e_x}{O_y} + {\rm{ (12x - 2y)}}HN{O_3} \to 3xFe{\left( {N{O_3}} \right)_3} + {\rm{ (3x - 2y)}}NO{\rm{ }} + (6x - y){\rm{ }}{H_2}O\)
* Tính toán theo phương trình hóa học
\(\begin{array}{*{20}{c}}{3F{e_x}{O_y}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}{\rm{ }}\begin{array}{*{20}{c}}{{\rm{(12x - 2y)}}HN{O_3}}\\{}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{3xFe{{\left( {N{O_3}} \right)}_3}}\\{0,3x/(3x - 2y)}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}{\rm{ }}\begin{array}{*{20}{c}}{{\rm{(3x - 2y)}}NO}\\{0,1}\end{array}{\rm{ }}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{(6x - y){\rm{ }}{H_2}O}\\{}\end{array}\)
\( \Rightarrow {m_{Fe{{(N{O_3})}_3}}} = \dfrac{{0,3x}}{{3x - 2y}}.242 = 72,6\)
Thay giá trị của x và y ở mỗi đáp án vào biểu thức tính khối lượng muối thấy x=y=1 thỏa mãn

