Nhiệt phân 50,56 gam KMnO4 sau một thời gian thu được 46,72 gam chất rắn. Cho toàn bộ lượng khí sinh ra phản ứng hết với hỗn hợp X gồm Mg, Fe thu được hỗn hợp Y nặng 13,04 gam. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch H2SO4 đặc, nóng dư thu được 1,344 lít SO2 (đktc). Phần trăm khối lượng Mg trong X là
Bảo toàn khối lượng: mKMnO4 = mchất rắn + mO2 => mO2 = 50,56 – 46,72 = 3,84 gam
=> nO2 = 0,12 mol
Bảo toàn khối lượng: mhh X + mO2 = mhh Y => mhh X = 13,04 – 3,84 = 9,2 gam
Gọi số mol của Mg và Fe trong X lần lượt là a và b mol
=> 24a + 56b = 9,2 (1)
Bảo toàn electron ta có: $2.{{n}_{Mg}}+3.{{n}_{F\text{e}}}=4.{{n}_{{{O}_{2}}}}+2.{{n}_{S{{O}_{2}}}}$
=> 2x + 3y = 4.0,12 + 2.0,06 = 0,6 (2)
Từ (1) và (2) => a = 0,15; b = 0,1
=> %mMg = 39,13%
Cho 17,6 gam hỗn hợp X gồm S, FeS, FeS2 tan hoàn toàn trong dung dịch HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 duy nhất và dung dịch Y. Cho Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa trong không khí đến khối lượng không đổi thu được 62,6 gam chất rắn. V có giá trị
Quy đổi hỗn hợp X gồm Fe và S với số mol lần lượt là a và b
=> mhh X = 56a + 32b = 17,6 (1)
$\left\{ \begin{gathered} S \hfill \\ F{\text{e}}S \hfill \\ F{\text{e}}{S_2} \hfill \\ \end{gathered} \right.\xrightarrow{{ + HN{O_3}}}\left\{ \begin{gathered} ddY\left\{ \begin{gathered} F{\text{e}}{(N{O_3})_3} \hfill \\ {H_2}S{O_4} \hfill \\ \end{gathered} \right.\xrightarrow{{ +Ba{{(OH)}_2}}}\left\{ \begin{gathered} F{\text{e}}{(OH)_3} \hfill \\ BaS{O_4} \hfill \\ \end{gathered} \right.\xrightarrow{{{t^o}}}\left\{ \begin{gathered} F{{\text{e}}_2}{O_3} \hfill \\ BaS{O_4} \hfill \\ \end{gathered} \right. \hfill \\ \uparrow N{O_2} \hfill \\ \end{gathered} \right.$
Bảo toàn Fe: ${{n}_{F{{\text{e}}_{2}}{{O}_{3}}}}=\frac{1}{2}.{{n}_{F\text{e}}}=0,5a\,mol$
Bảo toàn S: ${{n}_{BaS{{O}_{4}}}}={{n}_{S}}=b\,mol$
=> mchất rắn = 0,5a.160 + 233b = 62,6 (2)
Từ (1) và (2) => a = 0,2 mol; b = 0,2 mol
Bảo toàn electron: $3.{{n}_{F\text{e}}}+6.{{n}_{S}}=1.{{n}_{N{{O}_{2}}}}\Rightarrow {{n}_{N{{O}_{2}}}}=3.0,2+6.0,2=1,8\,mol$
=> V = 40,32 lít
Trong bình kín đựng O2 ở to và P1 (atm) , bật tia lửa điện, rồi đưa về to ban đầu thì áp suất là P2 (atm). Dẫn khí trong bình qua dung dịch KI dư thu được dung dịch X và 2,2848 lít khí (ở đktc). Dung dịch X phản ứng vừa đủ với 150 ml dung dịch H2SO4 0,08M. Hiệu suất phản ứng ozon hóa và giá trị P2 so với P1 là
nO2 dư = 0,102 mol
3O2 → 2O3 (1)
O3 + 2KI + H2O → 2KOH + O2 + I2 (2)
2KOH + H2SO4 → K2SO4 + H2O
nKOH = 2 nH2SO4 = 0,024 mol
nO3 = nO2 sinh ra ở phản ứng (2) = 0,5.nKOH = 0,012 mol
=> nO2 phản ứng (1) = 0,018 mol
nO2 sinh ra ở phản ứng (2) + nO2 dư ở (1) = 0,102
=> nO2 dư ở (1) = 0,09 mol
=> nO2 ban đầu = 0,09 + 0,018 = 0,108 mol
=> H = 0,018/0,108 .100% = 16,667 %
Ta có
\(\frac{{{\mathrm{P}}_{\mathrm{1}}}}{{{\mathrm{P}}_{2}}}\mathrm{=}\frac{{{\mathrm{n}}_{{{\mathrm{O}}_{\mathrm{2}}}\mathrm{bd}}}}{{{\mathrm{n}}_{{{\mathrm{O}}_{\mathrm{2}}}\,\mathrm{du}}}\mathrm{+}{{\mathrm{n}}_{{{\mathrm{O}}_{\mathrm{3}}}}}}\mathrm{=}\frac{\mathrm{0,108}}{\mathrm{0,09+0,012}}\mathrm{=}\frac{\mathrm{18}}{\mathrm{17}}\)
=> P2 = 0,944P1
Nhiệt phân hoàn toàn 22,26 gam hỗn hợp X gồm KClO3; KMnO4 và KCl thu được 3,36 lít khí O2 (đktc) và hỗn hợp Y gồm KCl, K2MnO4, MnO2 trong đó KCl chiếm 51,203% về khối lượng. Hòa tan hết hỗn hợp Y cần dùng dung dịch HCl 32,85% (đun nóng) thu được dung dịch Z. Nồng độ phần trăm của KCl có trong dung dịch Z là
Bảo toàn khối lượng:
mX = mY + mO2 = > mY = 22,26 – 0,15.32 = 17,46 gam
=> mKCl = 17,46. 51,203:100 = 8,94 g => nKCl = 0,12 mol
Gọi số mol KClO3 , KMnO4 , KCl lần lượt là : x, y, z
=> Ta có hệ phương trình
$\left\{ {\begin{array}{*{20}{l}}{122,5x + 158y + 74,5z = 22,26}\\{1,5x + 0,5y = 0,15}\\{x + z = 0,12}\end{array}} \right. = > \left\{ {\begin{array}{*{20}{l}}{x = 0,08}\\{y = 0,06}\\{z = 0,04}\end{array}} \right.$
=> nK2MnO4 = 0,03 mol; nMnO2 = 0,03 mol
K2MnO4 + 8HClđặc → 2KCl + MnCl2 + 2Cl2 + 4H2O
0,03 0,24 0,06 0,06
MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
0,03 0,12 0,03
=> $\sum{{{\mathrm{m}}_{\mathrm{KCl}}}\mathrm{=}}$8,94 + 0,06.74,5 = 13,41 gam
=> $\sum{{{\mathrm{m}}_{\mathrm{C}{{\mathrm{l}}_{2}}}}\mathrm{=}}$0,09.71 = 6,39 g
=> $\sum{{{\mathrm{n}}_{\mathrm{HCl}}}\mathrm{=}}$0,36 mol => mHCl = 13,14 gam => mdd HCl = 40 gam
=> mdd sau phản ứng = mY + mdd HCl – mCl2 = 17,46 + 40 - 6,39 = 51,07gam
=> $C{{\%}_{KCl}}=\frac{13,41}{51,07}.100\%=\text{ }26,26\text{ }\%$
Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kín thu được hỗn hợp X. Lấy 52,550 gam X đem nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và V lít khí O2. Biết KClO3 bị nhiệt phân hoàn toàn tạo 14,9 gam KCl chiếm 36,315% khối lượng Y. Sau đó, cho toàn bộ Y tác dụng hoàn toàn với axit HCl đặc dư đun nóng, sau phản ứng cô cạn dd thu được 51,275 gam muối khan. Hiệu suất của phản ứng nhiệt phân muối KMnO4 trong X là?
nKClO3 = nKCl = 0,2 mol
mY = 14,9 / 36,315% = 41,03 => nO2 = (mX – mY)/32 = 0,36
2KClO3 → 2KCl + 3O2
0,2 0,2 0,3
=> còn lại 0,36 – 0,3 = 0,06 mol O2 do KMnO4 nhiệt phân ra
2KMnO4 → K2MnO4 + MnO2 + O2
0,12 0,06
=> nKMnO4 phản ứng = 0,12
Ban đầu X chứa KMnO4 (a mol), MnO2 (b mol), KClO3 (0,2 mol)
mX = 158a + 87b + 122,5.0,2 = 52,55
Muối khan gồm KCl (a + 0,2) mol và MnCl2 (a + b) mol
=> 74,5.(a + 0,2) + 126.(a + b) = 51,275
=> a = 0,15 và b = 0,05
=> H = nKMnO4 phản ứng / nKMnO4 ban đầu = 80%
Hòa tan hết một lượng rắn X gồm FeS; FeS2 và Fe3O4 trong HNO3 dư thấy có 0,34 mol HNO3 phản ứng. Sau phản ứng thu được 5,6 lít (đktc) hỗn hợp NO, NO2 có tỉ khối so với H2 là 15,32 và dung dịch chỉ chứa HNO3 dư cùng 19,26 gam hỗn hợp muối. Biết chỉ xảy ra 2 quá trình khử N+5. Phần trăm khối lượng FeS2 trong X là
nNO = 0,24 mol; nNO2 = 0,01 mol
Đặt a, b, c là số mol FeS, FeS2, Fe3O4
Xét quá trình cho – nhận e:
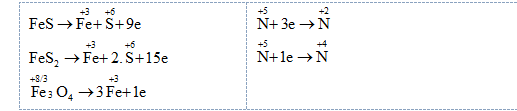
Bảo toàn electron: $9.{{n}_{F\text{e}S}}+15.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=3.{{n}_{NO}}+{{n}_{N{{O}_{2}}}}$
=> 9a + 15b + c = 0,24.3 + 0,01.1 (1)
Dung dịch sau phản ứng chứa:
Fe3+ : (a + b + 3c) mol
SO42- : (a + 2b) mol
NO3- : 0,34 – 0,24 – 0,01 = 0,09 mol (BTNT N)
Bảo toàn điện tích: $3.{{n}_{F{{\text{e}}^{3+}}}}=2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}$
=> 3.(a + b + 3c) = 2.(a + 2b) + 0,09 (2)
mmuối = 56.(a + b + 3c) + 96.(a + 2b) + 62.0,09 = 19,26 (3)
Từ (1), (2), (3) => a = 0,03 ; b = 0,03 ; c = 0,01
=> mhh X = 8,56 gam
=> %mFeS2 = 42,06%
Cho hỗn hợp bột X gồm Al, Fe2O3, Fe3O4 (có cùng số mol). Đem nung 41,9 gam hỗn hợp X trong điều kiện không có không khí thu được hỗn hợp Y. Hòa tan Y trong dung dịch H2SO4 đặc, nóng, dư thu được V lít khí SO2 (là sản phẩm khử duy nhất ở đktc). Giá trị V là
Gọi ${{n}_{Al}}={{n}_{F{{\text{e}}_{2}}{{O}_{3}}}}={{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=a\,mol$
=> mhh X = 27a + 160a + 232a = 41,9 => a = 0,1 mol
=> quy hỗn hợp X về Al (0,1 mol), Fe (0,1.2 + 0,1.3 = 0,5 mol) và O (0,1.3 + 0,1.4 = 0,7 mol)
Xét toàn bộ quá trình ta có:
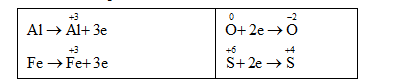
Bảo toàn e: 3.nAl + 3.nFe = 2.nO + 2.nSO2
=> nSO2 = (3.0,1 + 3.0,5 – 2.0,7) : 2 = 0,2 mol
=> V = 0,2.22,4 = 4,48 lít
Cho hỗn hợp gồm a mol FeS2 và b mol Cu2S tác dụng vừa đủ với dung dịch HNO3 thì thu được dung dịch A (chỉ chứa 2 muối sunfat) và 26,88 lít hỗn hợp khí Y gồm NO2 và NO ở điều kiện tiêu chuẩn (không còn sản phẩm khử nào khác), tỉ khối của Y so với H2 là 19. Cho dung dịch A tác dụng với Ba(OH)2 dư thì thu được kết tủa E. Nung E đến khối lượng không đổi thì thu được m gam chất rắn. Giá trị của m là:
Phản ứng chỉ tạo muối sunfat => bảo toàn nguyên tố và điện tích: 3.nFe + 2.nCu = 2.nS (SO4)
=> 3a + 2.2b = 2.(2a + b) => a = 2b
Xét Y: nY = 1,2 mol, MY = 38
Áp dụng quy tắc đường chéo: nNO = nNO2 = 0,6 mol
Coi hỗn hợp ban đầu gồm a mol Fe, 2b mol Cu, (2a + b) mol S
Bảo toàn e: 2.nCu + 3.nFe + 6.nS = nNO2 + 3.nNO
=> 4b + 3a + 6.(2a + b) = 0,6 + 0,6.3 = 2,4 mol
=> a = 0,12 mol và b = 0,06 mol
Cho Y tác dụng với Ba(OH)2 dư tạo kết tủa: 0,12 mol Fe(OH)3; 0,12 mol Cu(OH)2 và 0,3 mol BaSO4
=> nung thu được: 0,06 mol Fe2O3; 0,12 mol CuO và 0,3 mol BaSO4
=> m = 89,1 gam
Đốt m gam hỗn hợp X gồm Fe, Cu, Mg, Zn trong oxi thu được 29,7 gam hỗn hợp chất rắn Y. Hòa tan hết Y bằng dung dịch HNO3 đặc nóng dư thu được 13,44 lít khí NO2 (đktc). Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được khí SO2 và dung dịch Z chứa 84,1 gam muối. Biết rằng NO2 và SO2 là các sản phẩm khử duy nhất của HNO3 và H2SO4. Giá trị của m là
nNO2 = 0,6 mol
Bảo toàn khối lượng: ${{m}_{X}}+{{m}_{{{O}_{2}}}}={{m}_{Y}}\Rightarrow {{m}_{{{O}_{2}}}}=29,7m\text{ }\Rightarrow {{n}_{{{O}_{2}}}}=\frac{29,7-m}{32}$
Hòa tan hết Y vào HNO3 đặc, nóng dư
Bảo toàn e toàn quá trình: ${{n}_{e\text{ }KL\text{ }cho}}=4.{{n}_{{{O}_{2}}}}+1.{{n}_{N{{O}_{2}}}}=4.\frac{29,7-m}{32}+0,6=4,3125-0,125m$
Hỗn hợp X tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 84,1 gam muối
=> mKL + mSO42- = 84,1
Mà: ${{n}_{SO_{4}^{2-}}}=\frac{{{n}_{e\,cho}}}{2}=\frac{{{n}_{e\,KL\,cho}}}{2}=\frac{4,3125-0,125m}{2}$
=> $m+96.\frac{4,3125-0,125m}{2}=84,1\,\Rightarrow m=24,58$
Nung hỗn hợp gồm x mol Fe(NO3)2, y mol FeS2 và z mol FeCO3 trong bình kín chứa một lượng dư không khí. Sau khi các phản ứng xảy hoàn toàn đưa bình về nhiệt độ ban đầu thấy áp suất bình không đổi so với ban đầu. Mối liên hệ giữa x, y, z là
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4FeCO3 + O2 → 2Fe2O3 + 4CO2
Vì sau phản ứng thì áp suất trong bình không đổi
=> Số mol O2 phản ứng = số mol khí sinh ra = nO2 + nNO2 + nSO2 + nCO2
=> 2,75y + 0,25z = 0,25x + 2x + 2y + z
=> 2,25x + 0,75z = 0,75y
=> 3x + z = y
Hỗn hợp M gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam M nung nóng, sau một thời gian thu được hỗn hợp rắn N và hỗn hợp khí X có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ N trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16,75. Giá trị của m là
nCO ban đầu = 0,3 mol
Gọi nCO dư = x mol và nCO2 = y mol
Bảo toàn nguyên tố C: nCO ban đầu = nCO dư + nCO2 => x + y = 0,3 (1)
${{\bar{M}}_{X}}=\frac{28\text{x}+44y}{x+y}=18.2$
=> x = 0,15 mol; y = 0,15 mol
=> nO phản ứng = 0,15 mol
Ta có: mO ban đầu = $\frac{35,25.20,4255}{100}=7,2$ gam
=> nO ban đầu = 0,45 mol => nO còn lại = 0,3 mol
Gọi số mol NO và N2O lần lượt là a và b mol
Ta có: $\left\{ {\begin{array}{*{20}{l}}{a + b = 0,2{\mkern 1mu} mol}\\{\frac{{30{\rm{a}} + 44b}}{{a + b}} = 16,75.2}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{a = 0,15{\mkern 1mu} mol}\\{b = 0,05{\mkern 1mu} mol}\end{array}} \right.$
PT ion:
4H+ + NO3- + 3e → NO + 2H2O
10H+ + 2NO3- + 8e → N2O + 5H2O
2H+ + O (còn lại) → H2O
$\Rightarrow \sum{{{n}_{{{H}^{+}}phan\,ung}}}=4.{{n}_{NO}}+10.{{n}_{{{N}_{2}}O}}+2.{{n}_{O(con\,lai)}}=4.0,15+10.0,05+2.0,3=1,7\,mol$
Ta có: \({{n}_{NO_{3}^{-}}}\)tạo muối \(={{n}_{{{H}^{+}}}}-{{n}_{NO}}-2.{{n}_{{{N}_{2}}O}}\) = 1,7 – 0,15 – 0,05.2 = 1,45 mol
m = m kim loại + mNO3 tạo muối = 28,05 + 89,9 = 117,95 (gam)
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Vì %V của N2 và NO2 bằng nhau => qui đổi hh khí về NO (a mol) và N2O (b mol)
=> nkhí Z = a + b = 0,5
${{\bar{M}}_{Z}}=\frac{30\text{a}+44b}{a+b}=8,9.4$
=> a = 0,3 mol; b = 0,2 mol
Ta có: ${{n}_{HN{{O}_{3}}}}=4.{{n}_{NO}}+10.{{n}_{{{N}_{2}}O}}=4.0,3+10.0,2=3,2\,mol$
Nhiệt phân 40,3 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gian thu được khí O2 và 29,9 gam chất rắn Y gồm KMnO4, K2MnO4, MnO2 và KCl. Để hòa tan hoàn toàn Y cần vừa đủ dung dịch chứa 0,7 mol HCl. Phần trăm khối lượng KMnO4 bị nhiệt phân là
Nếu xét X phản ứng với HCl nghĩa là coi hỗn hợp O2 và Y phản ứng với HCl
Ta có: mO2 = mX – mY = 40,3 – 29,9 = 10,4 gam
=> nO2 = 0,325 mol
Xét: O2 + 4H+ → 2H2O
0,325 → 1,3 mol
=> tổng số mol HCl phản ứng với X = 1,3 + 0,7 = 2 mol
Đặt số mol mỗi chất trong X lần lượt là x và y
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
=> hệ PT: $\left\{ {\begin{array}{*{20}{l}}{8{\rm{x}} + 6y = 2}\\{158{\rm{x}} + 122,5y = 40,3}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{x = 0,1{\mkern 1mu} mol}\\{y = 0,2{\mkern 1mu} mol}\end{array}} \right.$
Vì Y gồm KMnO4, K2MnO4, MnO2 và KCl => KClO3 nhiệt phân hết
$\begin{align}& \Rightarrow {{n}_{{{O}_{2}}(KMn{{O}_{4}})}}={{n}_{{{O}_{2}}\,\sinh \,ra}}-{{n}_{{{O}_{2}}(KCl{{O}_{3}})}}=0,325-1,5.0,2=0,025\,mol \\& \Rightarrow {{n}_{KMn{{O}_{4}}pu}}=0,05\,mol \\\end{align}$
=> H = 50%
Nung hỗn hợp gồm 11,2 gam Fe; 6,4 gam Cu và 19,5 gam Zn với một lượng dư lưu huỳnh đến khi phản ứng hoàn toàn. Sản phẩm của phản ứng tác dụng với dung dịch HCl dư thu được khí B. Thể tích dung dịch Pb(NO3)2 20% (d = 1,1 g/ml) tối thiểu cần dùng để hấp thụ hết khí B là:
nFe = 0,2 mol; nCu = 0,1 mol; nZn = 0,3 mol
$\left\{ \begin{gathered} F{\text{e}} \hfill \\ Cu \hfill \\ Zn \hfill \\ \end{gathered} \right.\xrightarrow{{ + S,{t^o}}}\left\{ \begin{gathered} F{\text{e}}S \hfill \\ CuS \hfill \\ Zn{\text{S}} \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered} \left\{ \begin{gathered} F{\text{e}}C{l_2} \hfill \\ ZnC{l_2} \hfill \\ \end{gathered} \right. + {H_2}S \uparrow \hfill \\ CuS \hfill \\ \end{gathered} \right.$
CuS không tan trong dung dịch HCl
=> ${{n}_{{{H}_{2}}S}}={{n}_{F\text{e}S}}+{{n}_{ZnS}}={{n}_{F\text{e}}}+{{n}_{Zn}}=0,2+0,3=0,5\,mol$
H2S + Pb(NO3)2 → PbS + 2HNO3
0,5 → 0,5 mol
$\begin{array}{*{20}{l}}{ \Rightarrow {m_{dd{\kern 1pt} Pb{{(N{O_3})}_2}}} = \frac{{0,5.331.100\% }}{{20\% }} = 827,5{\mkern 1mu} (gam)}\\{ \Rightarrow {V_{dd}} = \frac{m}{d} = \frac{{827,5}}{{1,1}} = 752,27{\mkern 1mu} (ml)}\end{array}$
Hòa tan m gam hỗn hợp rắn gồm Fe(NO3)3, Cu và Fe3O4 trong dung dịch chứa 0,52 mol H2SO4 thu được dung dịch X chỉ chứa muối sunfat và 4,032 lít khí NO (sản phẩm khử duy nhất, đktc). Dung dịch X hòa tan tối đa 5,12 gam Cu (không thấy khí thoát ra). Giá trị m là.
Bảo toàn nguyên tố H => nH2O = 0,52 mol
nNO = 0,18 mol
Bảo toàn nguyên tố N => nFe(NO3)3 = 0,06 mol
${{n}_{{{H}^{+}}}}=4.{{n}_{NO}}+2.{{n}_{O}}\Rightarrow {{n}_{O}}=0,16\text{ }mol\text{ }\Rightarrow \text{ }{{n}_{F{{e}_{3}}{{O}_{4}}}}=0,04\text{ }mol$
Đặt nCu = x
Dung dịch X hòa tan tối đa 0,08 mol Cu tạo thành Fe2+
Xét toàn bộ quá trình có Cu cho e; Fe(NO3)3, Fe3O4 và NO3- nhận e
Bảo toàn electron: $2.({{n}_{Cu\,b\text{d}}}+{{n}_{Cu\,sau}})={{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}+2.{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}+3.{{n}_{NO}}$
=> 2.(x + 0,08) = 0,06 + 0,04.2 + 0,18.3
=> x = 0,26
=> m = 40,44 gam
Trộn 10,17 gam hỗn hợp X gồm Fe(NO3)2 và Al với 4,64 gam FeCO3 được hỗn hợp Y. Cho Y vào lượng vừa đủ dung dịch chứa 0,56 mol KHSO4 được dung dịch Z chứa 83,41 gam muối sunfat trung hòa và m gam hỗn hợp khí T trong đó có chứa 0,01 mol H2. Thêm NaOH vào Z đến khi toàn bộ muối sắt chuyển hết thành hidroxit và ngừng khí thoát ra thì cần 0,57 mol NaOH, lọc kết tủa nung trong không khí đến khối lượng không đổi thu được 11,5 gam chất rắn. Giá trị của m là
nFeCO3 = 0,04 mol
Giả sử trong X có x mol Fe(NO3)2 và y mol Al
=> 180x + 27y = 10,17g
Vì sau phản ứng thu được muối trung hòa
=> NO3 chuyển hết thành sản phẩm khử
Bảo toàn điện tích : ncation . điện tích = 2nSO4 = 1,12 mol
Khi Z + NaOH dư đến khí khí ngừng thoát ra
=> có NH4+
=> ncation(pứ với NaOH). Điện tích = 2nSO4 – nK+ = 0,56 mol < nNaOH
=> có 0,01 mol Al(OH)3 bị hòa tan
=> khi nung có Fe2O3 và Al2O3
=> mrắn = 80(x + 0,02) + 51(y – 0,005)= 11,5g
=> x = 0,04 mol ; y = 0,11 mol
mmuối Z = mFe + mAl + mNH4 + mK + mSO4 = 83,41g
=> nNH4 = 0,02 mol
=> Bảo toàn H : 2nH2O tạo ra = nKHSO4 – 4nNH4 – 2nH2 = 0,46 mol
=> nH2O tạo ra = 0,23 mol
Bảo toàn khối lượng: mX + mFeCO3 + mKHSO4 = mmuối Z + mH2O tạo ra + mkhí
=> mkhí = 3,42g
Cho a gam dung dịch H2SO4 có nồng độ A% tác dụng hết với lượng hỗn hơp 2 kim loại Na và Mg (kim loại lấy dư) thấy lượng H2 tạo ra là 0,05a gam. Giá trị của A% là
PTHH xảy ra: 2Na + H2SO4 → Na2SO4 + H2↑ (1)
Mg + H2SO4 → MgSO4 + H2↑ (2)
2Na + 2H2O → 2NaOH + H2↑ (3)
Đặt khối lượng dung dịch H2SO4 có a = 100 (g)
\( \Rightarrow {m_{{H_2}S{O_4}}} = \frac{{{m_{dd\,{H_2}S{O_4}}}}}{{100\% }}.A\% = \frac{{100}}{{100\% }}.A\% = A(g) \Rightarrow {n_{{H_2}S{O_4}}} = \frac{{{m_{{H_2}S{O_4}}}}}{{{M_{{H_2}S{O_4}}}}} = \frac{A}{{98}}\,\,(mol)\)
\( \Rightarrow {m_{{H_2}O}} = {m_{dd{H_2}S{O_4}}} - {m_{{H_2}S{O_4}}} = 100 - A(g) \Rightarrow {n_{{H_2}O}} = \frac{{{m_{{H_2}O}}}}{{{M_{{H_2}O}}}} = \frac{{100 - A}}{{18}}\,(mol)\)
Theo bài khối lượng H2 sinh ra = 0,05a = 0,05.100 = 5 (g) \( \Rightarrow {n_{{H_2}}} = \frac{{{m_{{H_2}}}}}{{{M_{{H_2}}}}} = \frac{5}{2} = 2,5\,(mol)\)
Theo PTHH (1), (2) và (3) ta thấy:
\(\begin{array}{l}\sum {{n_{H_2^{}(1) + (2) + (3)}} = \sum {{n_{{H_2}S{O_4}}} + \frac{1}{2}} } {n_{{H_2}O}}\\ \Rightarrow 2,5 = \frac{A}{{98}} + \frac{{100 - A}}{{36}}\\ \Rightarrow 2,5 - \frac{{100}}{{36}} = \frac{A}{{98}} - \frac{A}{{36}}\\ \Rightarrow \frac{5}{{18}} = \frac{{31A}}{{1764}}\\ \Rightarrow A = \frac{{5.1764}}{{18.31}} = 15,81\% \end{array}\)

