Hòa tan hết một lượng rắn X gồm FeS; FeS2 và Fe3O4 trong HNO3 dư thấy có 0,34 mol HNO3 phản ứng. Sau phản ứng thu được 5,6 lít (đktc) hỗn hợp NO, NO2 có tỉ khối so với H2 là 15,32 và dung dịch chỉ chứa HNO3 dư cùng 19,26 gam hỗn hợp muối. Biết chỉ xảy ra 2 quá trình khử N+5. Phần trăm khối lượng FeS2 trong X là
Trả lời bởi giáo viên
nNO = 0,24 mol; nNO2 = 0,01 mol
Đặt a, b, c là số mol FeS, FeS2, Fe3O4
Xét quá trình cho – nhận e:
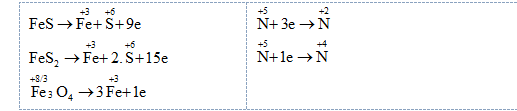
Bảo toàn electron: $9.{{n}_{F\text{e}S}}+15.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=3.{{n}_{NO}}+{{n}_{N{{O}_{2}}}}$
=> 9a + 15b + c = 0,24.3 + 0,01.1 (1)
Dung dịch sau phản ứng chứa:
Fe3+ : (a + b + 3c) mol
SO42- : (a + 2b) mol
NO3- : 0,34 – 0,24 – 0,01 = 0,09 mol (BTNT N)
Bảo toàn điện tích: $3.{{n}_{F{{\text{e}}^{3+}}}}=2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}$
=> 3.(a + b + 3c) = 2.(a + 2b) + 0,09 (2)
mmuối = 56.(a + b + 3c) + 96.(a + 2b) + 62.0,09 = 19,26 (3)
Từ (1), (2), (3) => a = 0,03 ; b = 0,03 ; c = 0,01
=> mhh X = 8,56 gam
=> %mFeS2 = 42,06%
Hướng dẫn giải:
Đặt a, b, c là số mol FeS, FeS2, Fe3O4
+) Bảo toàn electron: $9.{{n}_{F\text{e}S}}+15.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=3.{{n}_{NO}}+{{n}_{N{{O}_{2}}}}$
=> PT (1)
+) Bảo toàn điện tích: $3.{{n}_{F{{\text{e}}^{3+}}}}=2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}$
=> PT (2)
+) Khối lượng muối => PT (3)

