Trong các AO sau, AO nào là AO-pz?
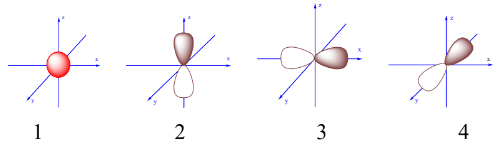
AO-pz có dạng hình số tám nổi được định hướng theo trục z => Hình 2
Lớp electron M có tối đa bao nhiêu electron:
Lớp M là lớp thứ 3, lớp này có chứa 3 phân lớp: s (tối đa 2e); p (tối đa 6e); d (tối đa 10e). Vậy lớp M có tối đa 2 + 6 +10 = 18 electron
Ở phân lớp 3d số electron tối đa là:
Số e tối đa của phân lớp 3d là 10.
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
Cấu hình e nguyên tử X là: 1s22s22p63s23p4 => ZX = 16
Lớp M (hay lớp thứ 3) có số electron tối đa là:
Đáp án A
Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành hình đám mây electron là cách nói theo
Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành hình đám mây electron là cách nói theo mô hình hiện đại
Đáp án A
Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái
Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái s, p, d, f.
Đáp án C
Số electron tối đa trên phân lớp f, d, p, s lần lượt là
Số electron tối đa trên phân lớp f, d, p, s lần lượt là 14, 10, 6, 2.
Đáp án A
Khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%) là
Khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%) là orbital nguyên tử.
Đáp án D
Số electron tối đa phân bố trên lớp thứ 3 trong vỏ nguyên tử là :
Lớp thứ 3 gồm các phân lớp s (tối đa 2e), p (tối đa 6e), d (tối đa 10e)
=> Số electron tối đa của lớp thứ 3 là 18 electron
Số electron tối đa trong lớp L là:
Lớp L là lớp thứ 2.
Số electron tối đa trong lớp L là 2.22 = 8 electron.
Số electron tối đa trên các phân lớp s và d lần lượt là:
Số electron tối đa trên các phân lớp s và d lần lượt là 2 và 10
Dãy nào trong các dãy sau đây gồm các phân lớp electron đã bão hòa?
Phân lớp electron bão hòa là phân lớp có số electron được điền tối đa:
Phân lớp s: có tối đa 2 electron
Phân lớp p: có tối đa 6 electron
Phân lớp d: có tối đa 10 electron
Phân lớp f: có tối đa 14 electron
Như vậy, dãy s2, p6, d10, f14 là các phân lớp electron đã bão hòa.
Số electron tối đa phân bố trên lớp thứ 4 trong vỏ nguyên tử là
2.42 = 32
Lớp thứ 2 có số phân lớp là
Lớp thứ 2 có 2 phân lớp là: 2s và 2p
Hãy cho biết lớp N có thể chứa tối đa bao nhiêu electron?
Lớp N là lớp thứ 4.
Vậy số electron tối đa của lớp N (lớp thứ 4) là 2.42= 32 electron.
Trong số các kí hiệu sau đây, kí hiệu nào sai?
Lớp thứ 3 có 3 phân lớp: 3s, 3p, 3d KHÔNG có phân lớp 3f
Số phân lớp electron trên lớp N bằng:
Lớp N là lớp thứ 4. Vậy lớp N có 4 phân lớp electron.
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 5 electron ở lớp M. Số proton có trong 1 nguyên tử X là:
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 5 electron ở lớp M (lớp thứ 3).
Suy ra cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p3.
Nguyên tử X có 15 e nên nguyên tử X có 15 proton.
Trong số các kí hiệu sau đây, kí hiệu nào sai?
Lớp thứ 3 có 3 phân lớp: 3s, 3p, 3d KHÔNG có phân lớp 3f

