Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
X có 7 electron p → X: 1s22s22p63s23p1 → X có số p = 13
Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên:
2py = 13.2 + 8 → py = 17
→ Y: 1s22s22p63s23p5
Tổng các hạt trong nguyên tử Y là 13. Số hạt mang điện dương ít hơn số hạt không mang điện là 1. Nhận xét nào sau đây không đúng?
Gọi số hạt trong Y là: p, n, e. Có
\(\left\{ \matrix{
{\rm{2p + n = 13}} \hfill \cr
{\rm{ - p + n = 1}} \hfill \cr} \right. \to \left\{ \matrix{
{\rm{p = 4}} \hfill \cr
{\rm{n = 5}} \hfill \cr} \right.\)
→ Cấu hình Y: 1s22s2. Y có số p, n, e lần lượt là: 4, 5, 4. → B đúng
Y là kim loại vì có 2e lớp ngoài cùng → C đúng, A sai
Điện tích hạt nhân của Y: +4.1,602.10-19 = +6,408.10-19C → D đúng
Hạt nhân của ion X+ có điện tích là 30,4.10-19 culông. Tên nguyên tử X là
+) Theo giả thiết : Hạt nhân của ion X+ có điện tích là 30,4.10-19 C nên nguyên tử X cũng có điện tích hạt nhân là 30,4.10-19 C (điện tích hạt nhân của ion và điện tích hạt nhân của nguyên tử là như nhau)
+) Mặt khác mỗi hạt proton có điện tích là 1,6.10-19 C nên suy ra số proton trong hạt nhân của X là :
$Số \,p = \frac{{30,{{4.10}^{ - 19}}}}{{1,{{6.10}^{ - 19}}}} = 19$ hạt
Vậy nguyên tử X là Kali (K).
Nguyên tử của nguyên tố X có tổng các hạt cơ bản là 180 hạt, trong đó các hạt mang điện nhiều hơn các hạt không mang điện là 32 hạt. Số khối của nguyên tử X là
- p, n, e lần lượt là số hạt proton, notron và electron trong nguyên tử nguyên tố X
Ta có tổng số hạt cơ bản trong X = 180 => n + p + e = 180
Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 32 => (p + e) - n = 32
- Ta có hệ phương trình:
$\left\{ \begin{gathered}p + e + n = 180 \hfill \\p + e - n = 32 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}2p + n = 180 \hfill \\2p - n = 32 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered}p = 53 \hfill \\n = 74 \hfill \\ \end{gathered} \right. \Rightarrow A = p + n = 127$
Nguyên tử X có tổng số hạt cơ bản là 40. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. X và cấu hình electron của nguyên tử X là
Trong nguyên tử của nguyên tố X có :
+) Tổng số hạt bằng 40 => p + e + n = 40 => 2p + n = 40
+) Số hạt mang điện nhiều hơn không mang điện là 12 => p + e - n = 12 => 2p - n = 12
Ta có hệ PT: $ \left\{ \begin{gathered}2p + n = 40 \hfill \\2p - n = 12 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}p = 13 \hfill \\n = 14 \hfill \\ \end{gathered} \right.$
p = 13 => X là Al
=> cấu hình e của X là : 1s22s22p63s23p1
Nguyên tử X có số khối nhỏ hơn 36 và có tổng các hạt là 52. X là
Tổng hạt = p + e + n = 52
=> 2p + n = 52 => n = 52 – 2p
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
=> p ≤ 52 – 2p ≤ 1,5p
=> $\dfrac{{52}}{{3,5}} \leqslant p \leqslant \dfrac{{52}}{3} \Rightarrow {\text{ }}14,9 \leqslant p \leqslant 17,3$
Nếu p = 15 => n = 22 => A = p + n = 37 (loại vì A < 36)
Nếu p = 16 => n = 20 => A = 36 (loại vì A < 36)
Nếu p = 17 => n = 18 => A = 35 (thỏa mãn, nguyên tố Cl)
Vậy X là Cl
Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 40. X là nguyên tố hóa học nào dưới đây?
Tổng hạt = p + e + n = 40 => n = 40 – 2p
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
=> p ≤ 40 – 2p ≤ 1,5p => 11,42 ≤ p ≤ 13,33
=> p = 12 hoặc p = 13
Với p = 12 => n = 16 => A = 28 (loại vì Si có A = 28 nhưng p = 14)
Với p = 13 => n = 14 => A = 27 (Al)
Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
Gọi pM , eM và nM là 3 hạt cơ bản của nguyên tố M
=> tổng số hạt cơ bản của ion M3+ là: pM + eM + nM -3 = 79
=> 2.pM + nM = 82 (1)
Trong ion M3+, số hạt mang điện là: pM và eM -3 (ion M3+ có ít hơn 3 electron so với nguyên tử M)
Mà tổng số hạt mang điện nhiều hơn không mang điện là 19
=> pM + eM - 3 - nM = 19 => 2pM – nM = 22 (2)
Từ (1) và (2) => pM = eM = 26; nM = 30
=> M là Fe
Tổng số hạt cơ bản của phân tử MClO3 là 182, trong đó tổng số hạt mang điện hơn số hạt không mang điện là 58. M là
Nguyên tử Cl có p = e = 17; n = 18
Nguyên tử O có p = e = 8; n = 8
Nguyên tử M có pM = eM và nM
=> Tổng số hạt cơ bản của phân tử MClO3 là:
pM + eM + nM + 17 + 17 + 18 + 3.(8 + 8 + 8) = 182
=> 2.pM + nM = 58 (1)
Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 58
=> pM + eM + 17 + 17 + 3.(8 + 8) – (nM + 18 + 3.8) = 58
=> 2.pM – nM = 18 (2)
Từ (1) và (2) => pM = 19; nM = 20
=> M là nguyên tố K
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron của X là
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
$\dfrac{{{M_X}}}{{2{M_Y}}} = \dfrac{{50}}{{50}} \Rightarrow \dfrac{{p + n}}{{2(p' + n')}} = 1 \Rightarrow p = 2p'$
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4
Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy X là
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nguyên tử O có pO = eO = 8 và nO = 8
Nguyên tử M có pM = eM và nM
=> Tổng số hạt cơ bản trong M2O là: 2.(pM + eM + nM) + pO + eO + nO = 140
=> 2.(2.pM + nM) + 8 + 8 + 8 = 140
=> 4.pM + 2.nM = 116 (1)
Tổng số hạt mang điện trong M2O là: 2.(pM + eM) + 8 + 8 = 4.pM + 16
Tổng số hạt không mang điện trong M2O là: 2.nM + 8
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 44 => 4.pM + 16 – (2.nM + 8) = 44
=> 4.pM – 2.nM = 36 (2)
Từ (1) và (2) ta có: pM = 19; nM = 20
=> M là kim loại K
=> Hợp chất X là: K2O
Tổng số hạt cơ bản trong phân tử R2X là 28 hạt. Biết rằng số khối của X lớn hơn số khối của R là 15, trong nguyên tử X số hạt mang điện gấp đôi số hạt không mang điện và nguyên tử R không có nơtron. Số proton trong nguyên tử X là
Gọi các hạt cơ bản trong R là: pR, eR, nR ; các hạt trong X là pX, eX, nX
+) Tổng số các hạt cơ bản trong R2X là 28 hạt
=> 2.(pR + eR + nR) + pX + eX + nX = 28
=> 2.(2.pR + nR) + 2.pX + nX = 28
=> 4.pR + 2.pX + 2.nR + nX = 28 (1)
+) Số khối của X lớn hơn số khối của R là 15 => AX – AR = 15
=> pX + nX – (pR + nR) = 15 (2)
+) Trong nguyên tử X số hạt mang điện gấp đôi số hạt không mang điện
=> pX + eX = 2.nX (3)
+) Nguyên tử R không có nơtron => nR = 0 (4)
Từ (1); (2), (3), (4) ta có hệ PT:
$\left\{ \begin{gathered}4.{p_R} + 2.{p_X} + 2.{n_R} + {n_X} = 28 \hfill \\{p_X} + {n_X}-\left( {{p_R} + {\text{ }}{n_R}} \right) = 15 \hfill \\{p_X} + {\text{ }}{e_X} = {\text{ }}2.{n_X} \hfill \\{n_R} = 0 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}4.{p_R} + 2.{p_X} + {n_X} = 28 \hfill \\- {p_R} + {p_X} + {n_X} = 15 \hfill \\{p_X} = {n_X} \hfill \\{n_R} =0\hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_R} = 1 \hfill \\{p_X} = 8 \hfill \\{n_X} = 8 \hfill \\{n_R} = 0 \hfill \\ \end{gathered} \right.$
Một hợp chất có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim ở chu kì 3. Trong hạt nhân của M có n - p = 4, trong hạt nhân của A có n’ = p’. Tổng số proton trong MAx là 58. Công thức của MAx là
Trong hợp chất MAx, M chiếm 46,67% về khối lượng nên :
$\dfrac{M}{{xA}} = \dfrac{{47,67}}{{53,33}} \Rightarrow \dfrac{{n + p}}{{x(n' + p')}} = \dfrac{{47,67}}{{53,33}} = \dfrac{7}{8}$
Thay n - p = 4 và n’ = p’ ta có :
$\dfrac{{2p + 4}}{{2xp'}} = \dfrac{7}{8}$ hay 4(2p + 4) = 7xp’
Tổng số proton trong MAx là 58 nên: p + xp’ = 58.
Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 $ \leqslant $ p’ $ \leqslant $ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.
Phân tử M3X2 có tổng số hạt cơ bản là 222, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 74. Tổng số hạt mang điện trong M2+ nhiều hơn tổng số hạt mang điện trong X3- là 21. Công thức phân tử M3X2 là
Gọi số hạt trong M là: pM, eM và nM
Số hạt trong X là pX, eX, nX
+) Tổng số hạt cơ bản trong phân tử M3X2 là 222
=> 3.(pM + eM + nM) + 2.(pX + eX + nX) = 222
Vì pM = eM và pX = eX => 3.(2.pM + nM) + 2.(2.pX + nX) = 222
=> 6.pM + 4.pX + 3.nM + 2.nX = 222 (1)
+) Trong M3X2, số hạt mang điện nhiều hơn số hạt không mang điện là 74
=> 3.(pM + eM) + 2.(pX + eX) – (3.nM + 2.nX) = 74
=> 6.pM + 4.pX – 3.nM – 2.nX = 74 (2)
Từ (1) và (2) => $\left\{ \begin{gathered}6{p_M} + 4{p_X} = 148\,\,\,(3) \hfill \\3{n_M} + 2{n_X} = 74 \hfill \\ \end{gathered} \right.$
+) Tổng số hạt mang điện trong M2+ là: pM + eM – 2 = 2.pM -2 (ion M2+ có ít hơn nguyên tử M 2 electron)
+) Tổng số hạt mang điện trong X3- là: pX + eX + 3 = 2.pX + 3 (ion X3- có nhiều hơn nguyên tử M 3 electron)
Tổng số hạt mang điện trong M2+ nhiều hơn tổng số hạt mang điện trong X3- là 21
=> 2.pM – 2 – (2.pX + 3) = 21 => pM - pX = 13 (4)
Từ (3) và (4) => pM = 20; pX = 7
=> M là Ca và X là N
=> Công thức phân tử hợp chất cần tìm là: Ca3N2
Phân tử M2X tạo thành từ M+ và X2-. Trong phân tử M2X có tổng số hạt cơ bản là 140 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của M+ lớn hơn số khối của X2- là 23. Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt. Công thức hóa học của M2X là
Gọi số hạt trong M là: pM, eM và nM
Số hạt trong X là pX, eX, nX
+) Tổng số hạt cơ bản trong phân tử M2X là 140
=> 2.(pM + eM + nM) + (pX + eX + nX) = 140
Vì pM = eM và pX = eX => 2.(2.pM + nM) + (2.pX + nX) = 140
=> 4.pM + 2.pX + 2.nM + nX = 140 (1)
+) Trong M2X, số hạt mang điện nhiều hơn số hạt không mang điện là 44
=> 2.(pM + eM) + (pX + eX) – (2.nM + nX) = 44
Vì pM = eM và pX = eX => 2.2.pM + 2.pX – 2.nM – nX = 44
=> 4.pM + 2.pX – (2.nM + nX) = 44 (2)
Từ (1) và (2) => $\left\{ \begin{gathered}4.{p_M} + 2.{p_X} = 92\,\,\,(3) \hfill \\2.{n_M} + {n_X} = 48\,\,\,(4) \hfill \\ \end{gathered} \right.$
+) Số khối của M+ lớn hơn số khối của X2- là 23 => pM + nM – (pX + nX) = 23 (5)
+) Tổng số hạt trong M+ nhiều hơn trong X2- là 31 hạt
=> pM + eM + nM -1 – (pX + eX + nX + 2) = 31
=> 2.pM + nM – 2.pX – nX = 34 (6)
Từ (5) và (6) => $\left\{ \begin{gathered}{p_M} - {p_X} = 11\,\,\,(7) \hfill \\{n_M} - {n_X} = 12 \hfill \\ \end{gathered} \right.$
Từ (3) và (7) => pM = 19; pX = 8
=> M là K và X là O
=> Công thức hợp chất cần tìm là K2O
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 6. A và B là các nguyên tố:
Cấu hình e của nguyên tử nguyên tố A là: 1s22s22p63s23p2
=> ZA = 14 => A là Si
Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 hay ZB – ZA = 3
=> ZB = 17 => B là Cl
Tổng số các haṭ trong nguyên tử của nguyên tố R là 114. Số haṭ mang điên nhiều hơn số haṭ không mang điên là 26 hạt. Số khối của R là
Gọi số p = số e = Z; số n = N
- Tổng số hạt: p + e + n = 2Z + N
- Số hạt mang điện: p + e = 2Z
- Số hạt không mang điện: N
Theo đề bài ta có:
\(\left\{ \begin{array}{l}
2Z + N = 114\\
2Z - N = 26
\end{array} \right. \to \left\{ \begin{array}{l}
Z = 35\\
N = 44
\end{array} \right.\)
=> Số khối A = Z + N = 35 + 44 = 79
Nguyên tử của một nguyên tố X có tổng số hạt cơ bản (proton, nơtron, và electron) là 82, biết số hạt mạng điện nhiều hơn số hạt không mang điện là 22. Kí hiệu hóa học của X là:
Đặt số p = số e = Z; số n = N
- Tổng số hạt cơ bản (proton, nơtron, và electron) là 82: 2Z + N = 82 (1)
- Số hạt mạng điện nhiều hơn số hạt không mang điện là 22: 2Z – N = 22 (2)
Giải (1) và (2) thu được Z = 26 và N = 30
=> A = Z + N = 26 + 30 = 56
Vậy kí hiệu hóa học của nguyên tố là \({}_{26}^{56}Fe\)
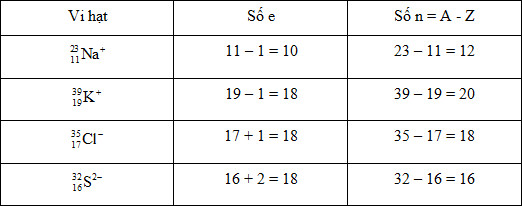
Vi hạt nào sau đây có số electron nhiều hơn số nơtron?
Tổng số hạt cơ bản (p, n, e) của một nguyên tử X là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 6. nguyên tử X là:
Đặt số p = số e = Z; số n = N
- Tổng số hạt cơ bản (proton, nơtron, và electron) là 26: 2Z + N = 26 (1)
- Số hạt mạng điện nhiều hơn số hạt không mang điện là 6: 2Z – N = 6 (2)
Giải (1) và (2) thu được Z = 8 và N = 10
=> A = Z + N = 8 + 10 = 18
Vậy kí hiệu hóa học của nguyên tố là \({}_8^{18}O\)

