Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p6 3s1; 1s22s22p63s2; 1s22s22p63s23p1. Dãy gồm các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là:
Tính khử tăng => tính kim loại tăng.
X, Y, Z đều thuộc chu kì 3
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm => tính khử giảm dần.
Tính khử lớn nhất là X, bé nhất là Z.
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Y có mức năng lượng 3p và có 1 electron lớp ngoài cùng
=> Cấu hình electron Y: 4s1
=> Cấu hình của Y là [Ar]4s1
=> ZY = 19.
=> có 1 electron ở lớp ngoài cùng => Y là kim loại.
Nguyên tử X và Y có số electron hơn kém nhau là 2 và mức năng lượng cao nhất của X là 3p. => ZX = 19-2 =17
=> Cấu hình của X là [Ne]3s23p5
=> có 7 electron ở lớp ngoài cùng => X là phi kim.
Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
M (Z = 11) $ \to $ M là Na: 1s22s22p63s1 → Na thuộc chu kì 3, nhóm IA
X (Z = 17) $ \to $ X là Cl: 1s22s22p63s23p5 → Cl thuộc chu kì 3, nhóm VIIA
Y (Z = 9) $ \to $ Y là F: 1s22s22p5 → F thuộc chu kì 2, nhóm VIIA
R (Z = 19) $ \to $ Z là K: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA
Vị trí các nguyên tố trong bảng tuần hoàn theo sơ đồ sau:
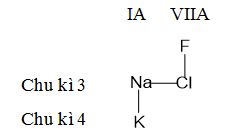
Độ âm điện tăng thì tính phi kim tăng mà đi từ trái qua phải, từ dưới lên tính phi kim tăng
=> Độ âm điện theo thứ tự tăng dần: K < Na < Cl < F
Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
K: [Ar]4s1 → chu kì 4, nhóm IA
N: 1s22s22p3 → chu kì 2, nhóm VA
Si: [Ne]3s23p2 → chu kì 3, nhóm IVA
Mg: [Ne]3s2 → chu kì 3, nhóm IIA
Vị trí các nguyên tố trong bảng tuần hoàn theo sơ đồ sau:
Chu kì càng lớn bán kính càng lớn:
=> K bán kính lớn nhất, N có bán kính bé nhất
Trong cùng một chu kì theo chiều trái qua phải bán kính giảm dần
=> Si bán kính bé hơn Mg
Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là:
7N: 1s22s22p3 → chu kì 2, nhóm VA
8O: 1s22s22p4 → chu kì 2, nhóm VIA
9F: 1s22s22p5 → chu kì 2, nhóm VIIA
15P: 1s22s22p63s23p3 → chu kì 3, nhóm VA
Vị trí trong bảng tuần hoàn theo sơ đồ sau:
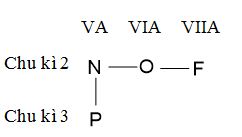
→ Trong bảng tuần hoàn, từ dưới lên trên trong một nhóm, từ trái sang phải trong một chu kì tính phi kim tăng dần.
→ Tính phi kim tăng dần: P < N < O < F
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét nào sau đây về X, Y là đúng?
X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp
TH1. pY – pX = 1 (X, Y thuộc chu kì 2, 3)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 17 \hfill \\{p_X} = 16 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^5} \hfill \\X:\,{\text{[}}Ne]3{s^2}3{p^4} \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,\,Cl \hfill \\X:\,\,S \hfill \\ \end{gathered} \right.$
A sai vì đơn chất X là chất rắn ở điều kiện thường
B sai vì trong 1 chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện tăng dần
$ \to $ Độ âm điện của Y lớn hơn độ âm điện của X
C sai vì lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 7 electron
TH2. pY – pX = 11 (X, Y thuộc chu kì 4, 5, 6, 7)
→$\left\{ \begin{gathered}{p_Y} + {p_X} = 33 \hfill \\{p_Y} - {p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{p_Y} = 22 \hfill \\{p_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}Y:\,{\text{[}}Ne]3{s^2}3{p^6}3{d^2}4{s^2} \hfill \\X:\,{\text{[}}Ne]3{s^1} \hfill \\ \end{gathered} \right.$
$ \to $Loại vì X, Y không thuộc cùng một chu kì
Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
TH1: Nếu X, Y thuộc chu kì 2, 3
$\begin{gathered}\to \left\{ \begin{gathered}{Z_X} + {Z_Y} = 51 \hfill \\{Z_Y} - {Z_X} = 1 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{Z_X} = 25 \hfill \\{Z_Y} = 26 \hfill \\ \end{gathered} \right. \hfill \\\to \left\{ \begin{gathered}X:{\text{[Ar}}]3{d^5}4{s^2} \hfill \\Y:{\text{[Ar}}]3{d^6}4{s^2} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→ nhóm B → loại
TH2: Nếu X, Y thuộc chu kì 4, 5 ,6, 7
$\begin{gathered} \to \left\{ \begin{gathered}{Z_X} + {Z_Y} = 51 \hfill \\{Z_Y} - {Z_X} = 11 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}{Z_X} = 20 \hfill \\{Z_Y} = 31 \hfill \\ \end{gathered} \right. \hfill \\\to \left\{ \begin{gathered}X:{\text{[Ar}}]4{s^2} \hfill \\Y:{\text{[Ar}}]3{d^{10}}4{s^2}4{p^1} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→ nhóm A → X là Ca , Y là Ga → B, C, D sai
A đúng vì trong dung dịch Ca kết hợp với nước tạo dung dịch Ca(OH)2 chứ không khử ion Cu2+ trong dung dịch: Ca + 2H2O $\xrightarrow{{}}$ Ca(OH)2 + H2↑
Phát biểu nào sau đây là sai?
A đúng theo SGK 10NC trang 32
B đúng theo SGK 10NC trang 59
C sai vì trong một chu kì: Zkim loại < Zphi kim → rkim loại > rphi kim
D đúng theo SGK 12CB trang 84
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là:
Hợp chất của nguyên tố R với H là RH3
=> R thuộc nhóm VA
=> oxit cao nhất của R là R2O5
Ta có:
$\% O = \dfrac{{16.5}}{{16.5 + 2R}} \cdot 100\% = 74,07\% \Rightarrow \,R = 14$
→ R là Nitơ
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
X có cấu hình electron lớp ngoài cùng là ns2np4
=> X thuộc nhóm IVA
=> hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có :
$\dfrac{X}{{X + 2}} \cdot 100\% = 94,12\% \to X = 32$
=> X là lưu huỳnh
Oxit cao nhất của S là SO3
=>$\% {m_S} = \dfrac{{32}}{{80}} \cdot 100\% = 40\% $
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
Gọi công thức phân tử của R với H là RHx → oxit cao nhất tương ứng có dạng R2O8-x
Ta có: Phần trăm về khối lượng của R trong công thức với Hiđro và trong công thức oxit cao nhất là: $\begin{gathered}a = \dfrac{R}{{R + x}} \cdot 100\% \,\,;\,\,b = \dfrac{{2R}}{{2R + 16.(8 - x)}} \cdot 100\% \, \hfill \\\to \dfrac{a}{b} = \dfrac{{2R + 16.(8 - x)}}{{2(R + x)}} = \dfrac{{11}}{4} \Leftrightarrow 14R + 86x = 512 \to \left\{ \begin{gathered}x = 4 \hfill \\R = 12 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→R là cacbon. Oxit cao nhất của C là CO2 : O = C = O (phân tử không phân cực).
→ A đúng
B sai do CO2 ở điều kiện thường là chất khí.
C sai do Cacbon thuộc chu kì 2.
D sai do Cacbon (ở trạng thái cơ bản): 6C: 1s22s22p2 → có 4 electron s và 2 electron p
Nguyên tố Y là phi kim thuộc chu kỳ 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là
Y có công thức oxit cao nhất là YO3
=> Y thuộc nhóm VIA
Mà Y thuộc chu kì 3 => Y là S
Trong phân tử MS có: $\% M = \dfrac{M}{{M + 32}} \cdot 100\% = 63,64\% \to M = 56$
Vậy M là Fe
Trong các hidroxit dưới đây, hidroxit nào có tính lưỡng tính?
Al(OH)3 là một hidroxit lưỡng tính.
Cấu hình electron nào sau đây là của nguyên tố thuộc nhóm VIIA?
Cấu hình electron của nguyên tố thuộc nhóm VIIA là 1s22s22p5
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Trong một chu kì các nguyên tố nhóm A theo chiều tăng dần điện tích hạt nhân, tính chất nào sau đây giảm dần?
Trong một chu kì các nguyên tố nhóm A theo chiều tăng dần điện tích hạt nhân, tính kim loại và tính bazo giảm dần
Trong một nhóm các nguyên tố nhóm A theo chiều tăng dần điện tích hạt nhân, tính chất nào biến đổi theo chiều biến đổi độ âm điện của các nguyên tố trong một nhóm?
Trong một nhóm các nguyên tố nhóm A theo chiều tăng dần điện tích hạt nhân, độ âm điện của các nguyên tố giảm dần
=> Tính chất biến đổi theo chiều biến đổi độ âm điện của các nguyên tố trong cùng một nhóm A theo chiều tăng dần điện tích hạt nhân là tính phi kim
Cho bảng thông tin về số lượng từng loại hạt trong các nguyên tử và ion sau đây:
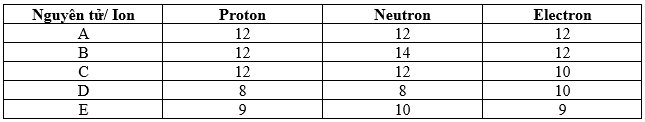
Cho các phát biểu sau:
(a) A và C là các nguyên tử trung hoà về điện
(b) C là một anion và có điện tích là 2+.
(c) D là một cation và có điện tích là 2-.
(d) A và B là đồng vị của một nguyên tố.
Số phát biểu đúng là
Từ bảng số liệu có
- Nguyên tử trung hoà về điện khi số proton = số electron => A, B, E thoả mãn => (a) sai
- Ion âm (hay gọi là anion) là D vì có số proton < số electron và có điện tích là 2- => (c) sai
- Ion dương (hay gọi là cation) là C vì có số proton > số electron và có điện tích là 2+ => (b) sai
- A và B là đồng vị của một nguyên tố vì có cùng số proton => (d) đúng
=> Số phát biểu đúng là 1
Cho mô hình cấu tạo của một số nguyên tố:
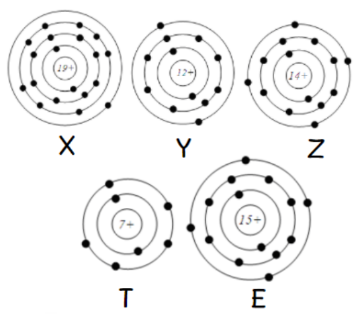
Phát biểu nào sau đây không đúng?
A đúng. Z, E có cùng 4 electron lớp ngoài cùng
B đúng vì Y, Z, E có cùng số lớp electron
C sai. Nguyên tố có 1, 2 hoặc 3 electron lớp ngoài cùng thì là kim loại => Nguyên tố X, Y
D đúng. Nguyên tố có 5, 6 hoặc 7 electron lớp ngoài cùng thì là phi kim => Nguyên tố T

