Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 18. Đốt cháy hoàn toàn 4,48 lít khí C2H4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Giá trị của V là
Trả lời bởi giáo viên
\({d_{X/{H_2}}} = {{{M_X}} \over {{M_{{H_2}}}}} \Rightarrow {M_X} = 18.2 = 36\;(g/mol)\)
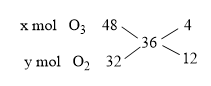
\( \Rightarrow {x \over y} = {4 \over {12}} = {1 \over 3}{\rm{ }} \Rightarrow {\rm{3x = y }}(1)\)
C2H4 \(\buildrel {{t^0}} \over\longrightarrow \) 2CO2 + 2H2O
0,2 0,4 0,4
BTNT O: nO trước = \(2{n_{{O_2}}} + 3{n_{{O_3}}}\)= 2y + 3x
nO sau = \(2{n_{C{O_2}}} + {n_{{H_2}O}}\)= 2.0,4 + 0,4 = 1,2
→ 3x + 2y = 1,2 (2)
Giải (1) và (2) ta được: \(x = {2 \over {15}};y = {2 \over 5} \Rightarrow {V_X}_{(dktc)} = ({2 \over {15}} + {2 \over 5}).22,4 \approx 11,95(l)\)
Hướng dẫn giải:
- Tìm tỉ lệ số mol giữa O2 và O3 dựa vào phương pháp đường chéo
- Áp dụng BTNT Oxi để tìm số mol từng khí → V

