Nguyên tử khối trung bình của K là 39,136. Biết K có ba đồng vị trong đó đồng vị 39K chiếm 93,26% và đồng vị 40K chiếm 0,012% số nguyên tử. Tính số khối của đồng vị còn lại?
Gọi số khối của đồng vị còn lại là A
Ta có % số nguyên tử của đồng vị AK là 100% - 93,26% - 0,012%= 6,728%
Nguyên tử khối trung bình của K là:
\(\overline {{A_K}} = {{39.93,26 + 40.0,012 + A.6,728} \over {100}} = 39,136\)
Giải phương trình trên ta có A= 41
Nguyên tử khối trung bình của rubiđi là 85,559. Trong tự nhiên rubidi có 2 đồng vị 85Rb và 87Rb. Xác định thành phần % số nguyên tử của đồng vị 85Rb?
Gọi % số nguyên tử của đồng vị 85Rb là x %, suy ra % số nguyên tử của đồng vị 87Rb là (100-x)%
Nguyên tử khối trung bình của rubiđi là 85,559 được tính theo công thức:
\(\overline {{A_{Rb}}} = \dfrac{{85x + 87(100 - x)}}{{100}} = 85,559\)
Giải phương trình trên ta được x = 72,05
Vậy thành phần % số nguyên tử của đồng vị 85Rb là 72,05%
Một nguyên tố X gồm 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Tính nguyên tử khối trung bình của X?
Giả sử đồng vị X1 có số proton là Z, có số electron là Z, có số notron là N → 2Z + N= 18 (1)
Vì các loại hạt trong X1 bằng nhau nên Z= N (2)
Giải hệ (1) và (2) ta có Z= N= 6
Số khối của đồng vị X1 bằng A1= Z + N= 6+6 = 12
Giả sử đồng vị X2 có số proton là Z, có số electron là Z, có số notron là N2 → 2Z + N2= 20 (3)
Thay Z = 6 vào (3) ta có N2= 8
Số khối của đồng vị X2 bằng A2= Z +N2= 6 + 8= 14
Vì phần trăm các đồng vị trong X bằng nhau nên mỗi đồng vị chiếm 50%.
Nguyên tử khối trung bình của X bằng:
\(\overline {{A_X}} = {{12.50 + 14.50} \over {100}} = 13\)
Trong tự nhiên brom có 2 đồng vị bền: 79Br chiếm 50,69% số nguyên tử và 81Br chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của brom bằng:
Nguyên tử khối trung bình của brom bằng:
\(\overline {{A_{Br}}} = \dfrac{{79.50,69 + 81.49,31}}{{100}} = 79,99\)
Nguyên tử khối trung bình của nguyên tố X là 79,91. Biết X có hai đồng vị trong đó đồng vị 81X chiếm 45,5% số nguyên tử. Tìm số khối của đồng vị còn lại?
Gọi số khối của đồng vị còn lại là A
% số nguyên tử của đồng vị AX là 100%- 45,5%= 54,5%
Nguyên tử khối trung bình của nguyên tố X là: \(\overline {{A_X}} = {{81.45,5 + A.54,5} \over {100}} = 79,91\)
Giải ra ta có A= 79
Silic (nguyên tử khối trung bình bằng 28,11) là hỗn hợp 3 đồng vị: 28Si, 29Si, 30Si; trong đó 28Si chiếm 92,2% số nguyên tử. Tính thành phần % số nguyên tử của đồng vị 30Si?
Gọi % số nguyên tử của đồng vị 29Si là x%
Suy ra % số nguyên tử của đồng vị 30Si là 100%- %28Si - %29Si= 100% - 92,2%-x% = (7,8 – x)%
Nguyên tử khối trung bình của Si là: \(\overline {{A_{Si}}} = {{28.92,2 + 29.x + 30.(7,8 - x)} \over {100}} = 28,11\)
Giải phương trình trên ta được x= 4,6
Vậy % số nguyên tử của đồng vị 30Si là (7,8-4,6)% = 3,2%
Khí hiđro có thể coi là hỗn hợp các phân tử H2 được cấu thành từ hai đồng vị 1H và 2H (đơteri, D). Một lít khí hiđro giàu đơteri ở đktc nặng 0,10 gam. Tính % số nguyên tử của đồng vị 2H?
Khối lượng mol trung bình của H2 là MH2= \({m \over n} = {{0,1} \over {1:22,4}} = 2,24\)
Suy ra nguyên tử khối trung bình của H bằng 2,24 : 2= 1,12
Gọi % số đồng vị 1H là x%; % số đồng vị 2H là (100-x)%
Nguyên tử khối trung bình của H là: \({{1.x + 2.(100 - x)} \over {100}} = 1,12\)
Giải phương trình trên ta có: x= 88
Vậy % số nguyên tử của đồng vị 2H là 100%- 88%= 12%
Trong tự nhiên, nguyên tố clo có hai đồng vị bền là \({}_{17}^{35}Cl\) và \({}_{17}^{37}Cl\) , trong đó đồng vị \({}_{17}^{35}Cl\) chiếm 75,77% số nguyên tử. Phần trăm khối lượng của \({}_{17}^{37}Cl\) trong CaCl2 là:
Ta có đồng vị \({}_{17}^{35}Cl\) chiếm 75,77% số nguyên tử nên đồng vị \({}_{17}^{37}Cl\) chiếm 24,23% số nguyên tử.
Nguyên tử khối trung bình của nguyên tố clo bằng:
\(\overline {{A_{Cl}}} = \dfrac{{37.24,23 + 35.75,77}}{{100}} = 35,4846\)
Phần trăm khối lượng của \({}_{17}^{37}Cl\) trong CaCl2 là:
%m37Cl= \(\dfrac{{2.37.0,2423.100\% }}{{40 + 35,4846.2}} = 16,16\% \)
Thành phần nào không được biểu diễn trong kí hiệu nguyên tử bất kì?
Đồng vị không được biểu diễn trong kí hiệu nguyên tử bất kì
Cho các kí hiệu nguyên tử sau: \({}_{14}^{28}Si,{}_{14}^{29}Si,{}_{14}^{30}Si\). Phát biểu nào sau đây không đúng?
A đúng vì các nguyên tử trên cùng số proton là 14
B đúng vì các nguyên tử trên cùng số proton và khác số khối
C sai
D đúng
Trong tự nhiên Br có 2 đồng vị \({}_{35}^{79}Br(54,5\% )\)và \({}_{35}^{81}Br(45,5\% )\). Nguyên tử khối trung bình của Br là
\(\mathop M\limits^\_ = \dfrac{{79.54,5 + 81.45,5}}{{100}} = 79,91\)
Với kết quả thu được, em có nhận xét gì về việc sử dụng doping của vận động viên này?
\(12,0310 = \dfrac{{x.12 + y.13}}{{100}}(1)\)
x+y=100 (2)
Từ (1) và (2) ⇒x=96,9 và y=3,1>1,11%
Vận động viên này đã sử dụng doping
Nguyên tố X có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là 81X (chiếm 45,5%). Nguyên tử khối của đồng vị thứ hai là
\( \Rightarrow \mathop {{M_X}}\limits^\_ = \dfrac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}} \Leftrightarrow 79,91 = \dfrac{{45,5.81 + (100 - 45,5).{A_2}}}{{100}} \Leftrightarrow {A_2} = 79\)
Nguyên tử khối của carbon trong testosterone tự nhiên trong cơ thể là
\( \Rightarrow \mathop M\limits^\_ = \dfrac{{12.98,98 + 13.1,11}}{{100}} = 12,0219\)
Boron là nguyên tố có nhiều tác dụng đối với cơ thể người như: làm lành vết thương, điều hoà nội tiết sinh dục, chống viêm khớp,... Do ngọn lửa cháy có màu lục đặc biệt nên boron vô định hình được dùng làm pháo hoa. Boron có hai đồng vị là 10B và 11B, nguyên tử khối trung bình là 10,81. Phần trăm số nguyên tử của 10B và 11B lần lượt là
Gọi phần trăm số nguyên tử của 10B và 11B lần lượt là x1 và x2
\( \Rightarrow \mathop M\limits^\_ = \dfrac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}} \Leftrightarrow 10,81 = \dfrac{{10{x_1} + 11{x_2}}}{{100}}\) (1)
Mà x1 + x2 = 100 (2)
Từ (1) và (2) => x1 = 19 và x2 = 81
Đồng vị phóng xạ cobalt (Co-60) phát ra tia \(\gamma \) có khả năng đâm xuyên mạnh, dùng điều trị các khối u ở sâu trong cơ thể. Cobalt có ba đồng vị 59Co (chiếm 98%), 58Co và 60Co, nguyên tử khối trung bình là 58,982. Phát biểu nào sau đây đúng?
Gọi phần trăm về số lượng nguyên tử của đồng vị 58Co và 60Co lần lượt là a và b
\( \Rightarrow \mathop M\limits^\_ = \dfrac{{59.98 + 58a + 60b}}{{100}} = 58,982\) (1)
Mà a + b + 98 = 100 (2)
Từ (1) và (2) => a = 1,9% và b = 0,1%
Nguyên tử khối trung bình của vanadium (V) là 50,9975. Nguyên tố V có 2 đồng vị, trong đó 51V chiếm 99,75% về số lượng nguyên tử. Số khối của đồng vị còn lại là
\(\mathop M\limits^\_ = \dfrac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}} \Leftrightarrow 50,9975 = \dfrac{{51.99,75 + (100 - 99,75).{A_2}}}{{100}} \Leftrightarrow {A_2} = 50\)
Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết 79R chiếm 54,5%, Nguyên tử khối của đồng vị còn lại có giá trị nào ?
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình: \(\overline A = \dfrac{{79.54,5 + A.45,5}}{{100}} = 79,91 \to A = 81\)
Krypton là một trong những khí hiếm được ứng dụng trong chiếu sáng và nhiếp ảnh. Ánh sáng của Krypton có nhiều dải phổ, do đó nó được sử dụng nhiều làm tia laser có mức năng lượng cao. Cho hình sau đây biểu thị phổ khối của Krypton:
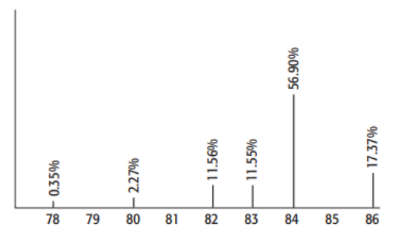
Giá trị nguyên tử khối trung bình của Krypton là (làm tròn đến chữ số thập phân thứ hai)
\(\mathop M\limits^\_ = \dfrac{{78.0,35 + 80.2,27 + 82.11,56 + 83.11,55 + 84.56,9 + 86.17,37}}{{100}} \simeq 83,89\)
Công nghệ phổ khối lượng ngày nay rất nhạy để phát hiện ra những sự thay đổi cực kì nhỏ về hàm lượng các đồng vị bền của một nguyên tố hoá học, tuỳ thuộc vào nơi lấy mẫu. Vì vậy các nhà khoa học khai thác triệt để những khác biệt này để xác định nguồn gốc mẫu nguyên tố.
Giả sử bạn được cung cấp một mẫu boron, bằng phương pháp phân tích phổ khối lượng bạn xác định được phần trăm số nguyên tử của \({}^{10}B\) là 18,2% và \({}^{11}B\) là 81,8%. Tham khảo bảng dưới đây và xác định nguồn gốc mẫu boron trên?
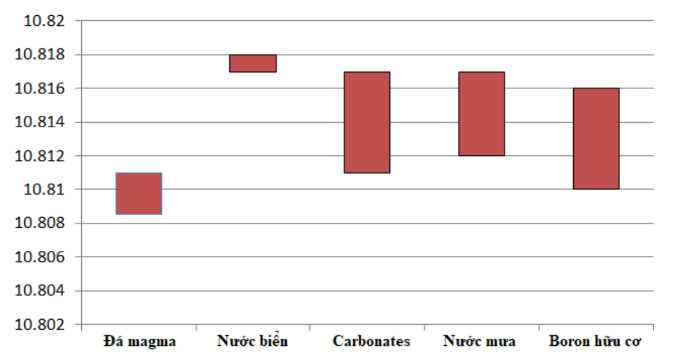
\(\mathop {{M_B}}\limits^\_ = \dfrac{{10.18,2 + 11.81,8}}{{100}} = 10,818\)
Từ bảng trên suy ra mẫu boron được lấy từ nước biển

