Nguyên tố Na được kí hiệu: \({}_{11}^{23}Na\). Số p, n, e trong nguyên tử Na lần lượt là:
p = e = 11
n = A - p = 12
Nitơ trong tự nhiên là hỗn hợp gồm 2 động vị là 14N (99,63%) và 15N (0,37%)Nguyên tử khối trung bình của nitơ là:
![]() = 14,0037
= 14,0037
=> Đáp án B
Hiđro có 3 đồng vị là 1H, 2H, 3H Oxi có 3 đồng vị là 16O, 17O, 18O. Trong tự nhiên, loại phân tử nước có phân tử khối lớn nhất là:
Nước có công thức : H2O : phân tử khối của nước lớn nhất khi phân tử khối của H và O là lớn nhất
=> 3H và 18O là lớn nhất => M H2O = 3 . 2 + 18 = 24
Nhận định nào sau đây là đúng khi nói về 3 nguyên tử 2613X, 5526Y, 2612Z:
B Sai vì đồng vị phải cùng số proton.
C Sai vì cùng 1 nguyên tố hóa học thì số proton phải bằng nhau.
D Sai vì nX = 13 còn nY = 29.
=>A
Cacbon có 2 đồng vị 12C và 13C. Oxi có 3 đồng vị 16O ; 17O ; 18O. Số loại phân tử CO2 có tạo thành là
Các loại phân tửa CO2 có thể tạo ra là:
|
12C16O16O |
12C 17O17O |
12C 18O18O |
|
12C 16O17O |
12C 17O18O | 12C 16O18O |
|
13C 16O16O |
13C 17O17O | 13C 18O18O |
|
13C 16O17O |
13C 17O18O | 13C 16O18O |
Trong tự nhiên, clo (Cl) có hai đồng vị bền là 35Cl và 37Cl. Mỗi đồng vị đó lần lượt chiếm 75% và 25%. Nguyên tử khối trung bình của clo là:
Xét 1 mol Clo thì có : 0,75 mol 35Cl và 0,25 mol 37Cl
=> Mtb(Cl) = 0,75.35 + 0,25.37 = 35,5g
=>B
Trong thiên nhiên Ag có 2 đồng vị, đồng vị 44Ag107(56%). Tính số khối của đồng vị thứ hai. Biết nguyên tử khối trung bình của Ag là 107,88.
% của đồng vị còn lại là : 100 % - 56 % = 44 %
=> ![]() => X = 109
=> X = 109
=> Đáp án A
Bo là nguyên tố dinh dưỡng thiết yếu đối với cây trồng. Ngày nay trên 70 quốc gia đã được phát hiện tình trạng thiếu Bo ở hầu hết các loại cây trên nhiều loại đất. Phân Bo cũng đã được sử dụng rộng rãi trên thế giới. Trong tự nhiên, Bo có 2 đồng vị . Biết \({}_5^{10}B\) chiếm 18,8%. Khối lượng nguyên tử trung bình của bo là 10,812. Số khối của đồng vi ̣thứ 2 là
Theo đề bài ta có:
\(10,812 = \dfrac{{18,8.10 + 81,2.{A_2}}}{{100}} \to {A_2} = 11\)
Trong tự nhiên đồng (Cu) có hai đồng vị bền là 63Cu và 65Cu. Tỉ lệ phần trăm của đồng vị 65Cu trong hỗn hợp là: (biết nguyên tử khối trung bình của Cu là 63,546)
Xét 1 mol Cu có x mol 65Cu và (1 – x) mol 63Cu
=> MCu = 65x + 63.(1 – x) = 63,546
=> x = 27,3%
=>A
Khối lượng Nguyên tử trung bình của Brom là 79,91. Brom có 2 đồng vị trong đó đồng vị 79Br chiểm 54,5%. Số khối của đồng vị thứ 2 sẽ là
Gọi A2 là số khối của nguyên tử dồng vị thứ 2.
Ta có:
\(\begin{gathered}
\frac{{79.54,5 + {A_2}(100 - 54,5)}}{{100}} = 79,91 \hfill \\
= > 4305,5 + 45,5{A_2} = 7991 \hfill \\
= > 45,5{A_2} = 7991 - 4305,5 \hfill \\
= > 45,5{A_2} = 3685,5 \hfill \\
= > {A_2} = 81 \hfill \\
\end{gathered} \)
Nguyên tố Bo có 2 đồng vị bền là 11B (x1 %) và 10B (x2 %), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1 % là:
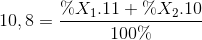
%X1 + %X2= 100 %
=> %X1 = 80% ; %X2 = 20%
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
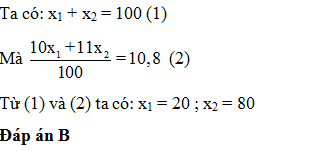
Nguyên tử khối trung bình của Sb là 121,76. Sb có 2 đồng vị biết 121Sb chiếm 62% . Số khối của đồng vị thứ 2 là:
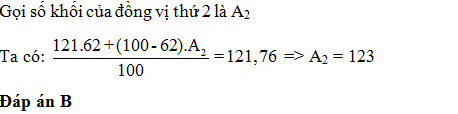
Bo có 2 đồng vị 10B và 11B. Nguyên tử khối trung bình của Bo là 10,812. Mỗi khi có 94 nguyên tử 10Bo thì sẽ có
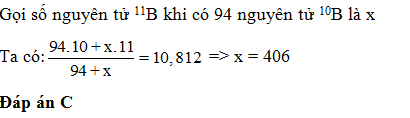
Nguyên tử khối trung bình của đồng là 63,546. Trong tự nhiên nguyên tố đồng có hai đồng vị 63Cu và 65Cu. Tính % số nguyên tử của đồng vị 65Cu?
Gọi % số nguyên tử của đồng vị 63Cu là x%, gọi % số nguyên tử của đồng vị 65Cu là y%.
Nguyên tử khối trung bình của đồng là:
\(\overline {{A_{Cu}}} = {{63x + 65y} \over {100}} = 63,546\)
Suy ra 63x + 65y= 63,546.100= 6354,6 (1)
Mặt khác x + y =100 (2)
Giải hệ trên ta có x = 72,7 và y = 27,3
Vậy % số nguyên tử của đồng vị 65Cu là 27,3%
Cho 2 kí hiệu nguyên tử: \({}_{11}^{23}Na\) và \({}_{12}^{23}Mg\) . Chọn câu trả lời đúng:
Nguyên tử \({}_{11}^{23}Na\) có số e = số p = 11 và số n= 23- 11= 12 hạt.
Nguyên tử \({}_{12}^{23}Mg\) có số e= số p = 12 và số n = 23- 12= 11 hạt.
Vậy phát biểu A sai.
Na và Mg có số p khác nhau nên không là đồng vị của nhau. Vậy phát biểu C sai.
Hạt nhân của nguyên tử Na có 23 hạt, hạt nhân của nguyên tử của Mg có 23 hạt. Vậy phát biểu D đúng.
Hạt nhân nguyên tử Na có điện tích là 11+, hạt nhân Mg có điện tích là 12+. Vậy phát biểu B sai.
Trong tự nhiên đồng có 2 đồng vị là 65Cu và 63Cu, trong đó tỉ lệ số nguyên tử 65Cu : 63Cu bằng 81:219. Nguyên tử khối trung bình của đồng là?
Nguyên tử khối trung bình của đồng là:
\(\overline {{A_{Cu}}} = {{65.81 + 63.219} \over {81 + 219}} = 63,54\)
Neon có hai đồng vị là 20Ne và 22Ne. Biết nguyên tử khối trung bình của Ne bằng 20,18. Hãy tính xem ứng với 18 nguyên tử 22Ne thì có bao nhiêu nguyên tử 20Ne?
Giả sử phần trăm số nguyên tử của đồng vị 20Ne và 22Ne lần lượt là x, y.
Ta có hệ phương trình: x + y = 100
\(\overline {{A_{Ne}}} = {{20x + 22y} \over {100}} = 20,18\)
Giải hệ trên ta có x= 91 và y= 9
Vậy nếu có 18 nguyên tử 22Ne thì có \({{18.91} \over 9} = 182\) nguyên tử 20Ne.
Nguyên tử khối trung bình của rubiđi là 85,559. Trong tự nhiên rubiđi có hai đồng vị 85Rb và 87Rb. Tính % số nguyên tử của đồng vị 85Rb?
Gọi % số nguyên tử của đồng vị 85Rb là x%, gọi % số nguyên tử của đồng vị 87Rb là y%.
Nguyên tử khối trung bình của rubiđi là:
\(\overline {{A_{Rb}}} = {{85x + 87y} \over {100}} = 85,559\)
Suy ra 85x + 87y = 100.85,559= 8555,9 (1)
Mặt khác x + y =100 (2)
Giải hệ trên ta có x = 72,05 và y= 27,95
Vậy % số nguyên tử của đồng vị 85Rb là 72,05%.
Nguyên tử khối trung bình của vàng bằng 16,40 lần nguyên tử khối của cacbon. Nguyên tử khối của cacbon bằng 12,011. Tính nguyên tử khối trung bình của vàng?
Nguyên tử khối trung bình của vàng là AAu= 16,40. AC= 16,40. 12,011= 196,98

