Cho phổ khối của nguyên tố X được biểu diễn trong hình sau:
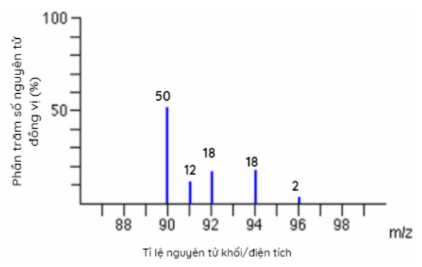
Nguyên tử khối trung bình của X là
\(\mathop {{M_X}}\limits^\_ = \dfrac{{50.90 + 91.12 + 18.92 + 18.94 + 2.96}}{{100}} = 91,32\)
Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về
Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về số nơtron.
Nguyên tố hóa học là tập hợp các nguyên tử có cùng:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng điện tích hạt nhân.
Phát biểu nào dưới đây không đúng?
Phát biểu không đúng là: Khối lượng của nguyên tử bằng tổng khối lượng của proton và electron.
Trong các dãy kí hiệu nguyên tử sau: \({}_7^{14}A,\,\,{}_9^{19}B,\,\,{}_{26}^{56}E,\,\,{}_{27}^{56}F,\,\,{}_8^{17}G,\,\,{}_{10}^{20}H,\,\,{}_{11}^{23}I,\,\,{}_{10}^{22}M\)
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hóa học ?
Các kí hiệu cùng 1 nguyên tố hóa học là: \(\,{}_{10}^{20}H,\,\,{}_{10}^{22}M\)
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là?
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là: 1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
Khối lượng của một nguyên tử đồng vị cacbon 12 là:
1u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12 => Khối lượng nguyên tử của đồng vị cacbon 12 là 12u
+) Mà 1u = 1,6605.10-27 kg
=> m = 12 . 1,6605.10-27 = 1,9926.10-26 kg = 1,9926.10-23 gam
Biết khối lượng của nguyên tử cacbon 12 gấp 11,9059 lần khối lượng của nguyên tử hiđro. Hỏi khối lượng của nguyên tử hiđro bằng bao nhiêu u?
+) Khối lượng nguyên tử cacbon 12 là 12u
Theo đầu bài: MC = 11,9059.MH
=> khối lượng nguyên tử hiđro là: ${{M}_{H}}=\frac{{{M}_{C}}}{11,9059}=\frac{12}{11,9059}=1,0079\,(u)$
Cho biết khối lượng của nguyên tử cacbon 12 là 19,9265 . 10-27 kg; khối lượng nguyên tử của Be là 9,012u. Khối lượng của Be là bao nhiêu gam?
1u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12
$=>\text{ }1u=\frac{19,{{9265.10}^{-27}}}{12}~=1,{{6605.10}^{-27}}kg$
=> khối lượng nguyên tử của Be = 9,012u = 9,012 . 1,6605 . 10-27 = 14,964.10-27 kg = 14,964.10-24 gam
Nguyên tử cacbon 12 gồm có
Nguyên tử cacbon 12 gồm có : hạt nhân có 6 proton và 6 nơtron và vỏ nguyên tử có 6 electron.
Hãy cho biết điều khẳng định nào sau đây không đúng ?
Điều khẳng định không đúng là: Chỉ có hạt nhân nguyên tử oxi mới có 8 nơtron.
Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là
M có 75e => M có 75p hay Z = 75
=> Số khối của M là: A = p + n = 75 + 110 = 185
=> Kí hiệu của nguyên tử M là: \({}_{75}^{185}M\)
Nguyên tử X không có nơtron trong hạt nhân nguyên tử. Nguyên tử X là
Nguyên tử X không có nơtron trong hạt nhân nguyên tử. Nguyên tử X là \({}_1^1H\)
Agon tách ra từ không khí là hỗn hợp của 3 đồng vị: 99,6% 40Ar, 0,063% 38Ar, 0,337% 36Ar. Tính thể tích của 10 gam Ar ở điều kiện tiêu chuẩn.
Số khối \({\bar A_{Ar}} = \frac{{99,6.40 + 0,063.38 + 0,337.36}}{{100}} = 39,985\)
$ = > {\rm{ }}{n_{Ar}} = \frac{{10}}{{39,985}} = 0,25\,\,mol\,\, = > \,\,V = 0,25.22,4 = 5,6\,L$
Đồng có 2 đồng vị \({}_{29}^{63}Cu\)và \({}_{29}^{65}Cu\). Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm số nguyên tử của mỗi đồng vị là
Gọi phần trăm đồng vị \({}_{29}^{63}Cu\)là a% => phần trăm đồng vị \({}_{29}^{65}Cu\) là (100 – a)%
Ta có : \(\bar A = \frac{{63{\rm{a}} + 65.(100 - a)}}{{100}} = 63,54\,\,\, = > a = 73\)
Vậy phần trăm mỗi đồng vị là 73% \({}_{29}^{63}Cu\)và 27% \({}_{29}^{65}Cu\)
Phát biểu nào sau đây là không đúng?
A sai vì đồng vị là những nguyên tử mà hạt nhân có cùng số proton nhưng khác số nơtron.
Khối lượng nguyên tử trung bình của bo (B) là 10,812. Số nguyên tử \({}_5^{11}B\) khi có 94 nguyên tử \({}_5^{10}B\) là
Ta có: \(\bar M = \frac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}} = \frac{{{x_1}.10 + (100 - {x_1}).11}}{{100}} = 10,812\,\, = > \,\,{x_1} = 18,8\% \)
=> phần trăm số lượng của \({}_5^{11}B\) là: 100% - 18,8% = 81,2%
=> tỉ lệ số nguyên tử \(\frac{{{}_5^{11}B}}{{{}_5^{10}B}} = \frac{{81,2}}{{18,8}}\)
=> số nguyên tử \({}_5^{11}B\) khi có 94 nguyên tử \({}_5^{10}B\) là: \(94.\frac{{81,2}}{{18,8}} = 406\) nguyên tử
Hai đồng vị có số khối trung bình 40,08 đvC. Hai đồng vị này có số nơtron hơn kém nhau là 2. Đồng vị có số khối nhỏ chiếm 96%. Số khối mỗi đồng vị là
Số khối trung bình 2 đồng vị:
A = 0,96.A1 + 0,04.A2 = 40,08 => (Z + N).0,96 + (Z + N + 2).0,04 = 40,08
=> Z + N = 40
Vậy số khối 2 đồng vị lần lượt là 40 và 42 đvC
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị \({}_1^2H\)trong 1 ml nước (cho rằng trong nước chỉ có 2 đồng vị \({}_1^2H,\,\,{}_1^1H\)), cho M = 18, khối lượng riêng của nước là 1 g/ml ?
Áp dụng công thức: m = D.V => \({m_{{H_2}O}} = 1{\rm{ }}gam => {n_{{H_2}O}} = \frac{1}{{18}}\,mol\)
=> số phân tử H2O $ = \frac{{6,{{02.10}^{23}}}}{{18}} = 3,{34.10^{22}}$
=> Tổng số nguyên tử H = 2 . số phân tử H2O
Đặt x và y lần lượt là số nguyên tử \({}_1^2H\)và \({}_1^1H\)
=> x + y = 6,68.1022
+) Nguyên tử khối trung bình của H là 1,008
Mà trong 6,68.1022 nguyên tử H gồm ${}_{1}^{2}H$và ${}_{1}^{1}H$
=> Khối lượng của 6,68.1022 nguyên tử H là: 2x + y = 1,008.6,68.1022
=> x = 5,344.1020 và y = 6,626.1022 nguyên tử
Nguyên tử khối của B là 10,81. B gồm 2 đồng vị 10B và 11B. Phần trăm đồng vị 11B trong H3BO3 (biết MH = 1 và MO = 16) là
\({\overline A _B} = \frac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}} = \frac{{{x_1}.10 + (100 - {x_1}).11}}{{100}} = 10,81\,\, = > \,\,{x_1} = 19\% \)
+) Lấy 1 mol H3BO3 (61,81 gam) trong đó có chứa 1 mol B => có 0,19 mol 10B và 0,81 mol 11B
=> khối lượng 11B = 0,81.11 = 8,91
\( = > \,\,\% {m_{{}^{11}B}} = \frac{{{m_{{}^{11}B}}}}{{{m_{{H_3}B{O_3}}}}}.100\% = \frac{{8,91}}{{61,81}}.100\% = 14,42\% \)

