Ở 200C khi hòa tan 30 gam BaCl2 vào 50 gam nước thấy có 12,1 gam BaCl2 không tan. Tính độ tan của BaCl2 ở nhiệt độ trên?
Khối lượng BaCl2 tan được trong 50 gam nước là 30 - 12,1 = 17,9 (gam).
Độ tan của BaCl2 ở 200C là S = (17,9/50).100 = 35,8 gam.
Hòa tan hoàn toàn 3,2 gam oxit M2Om trong dung dịch H2SO4 10% (vừa đủ) thu được dung dịch muối có nồng độ 12,9%. Sau phản ứng đem cô bớt dung dịch và làm lạnh nó thu được 7,868 gam tinh thể muối với hiệu suất kết tinh là 70%. Xác định công thức của tinh thể muối đó.
Bước 1: Tính mdd H2SO4 10%
- Giả sử có 1 mol M2Om phản ứng.
PTHH: M2Om + mH2SO4 ⟶ M2(SO4)m + mH2O
⟹ mdd H2SO4 10% = $\frac{{98m}}{{10}}.100$= 980m (g)
Bước 2: Tính \({m_{{M_2}{{(S{O_4})}_m}}}\)và tìm CT của oxit
- Khối lượng dung dịch thu được là: (3,2M + 16m) + 980m = 3,2M + 996m (g)
Số gam muối là: 2M + 96m (g)
- Ta có C% = \(\dfrac{{2M + 96m}}{{2M + 996m}}.100\% \) = 12,9% ⟹ M = 18,65m
Nghiệm phù hợp là m = 3 và M = 56 (Fe).
Vậy oxit là Fe2O3.
Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2O
nFe2O3 = \(\dfrac{{3,2}}{{160}}\) = 0,02 mol
Bước 3: Xác định CT của tinh thể muối
Vì hiệu suất là 70% nên số mol Fe2(SO4)3 tham gia kết tinh là: 0,02.70% = 0,014 mol
Nhận thấy số gam Fe2(SO4)3 = 0,014.400 = 5,6 gam < 7,868 gam nên tinh thể là muối ngậm nước.
- Đặt CTHH của muối tinh thể là Fe2(SO4)3.nH2O.
Ta có: 0,014.(400 + 18n) = 7,868 ⟹ n = 9.
- Công thức của tinh thể là Fe2(SO4)3.9H2O.
Ở toC khi cho 2 gam MgSO4 vào 200 gam dung dịch MgSO4 bão hòa đã làm cho m gam tinh thể muối MgSO4.nH2O (A) kết tinh. Nung m gam tinh thể A cho đến khi mất nước hoàn toàn thì thu được 3,16 gam MgSO4. Xác định công thức phân tử của tinh thể muối A. Cho biết độ tan của MgSO4 ở toC là 35,1 gam.
- Công thức tinh thể là MgSO4.nH2O.
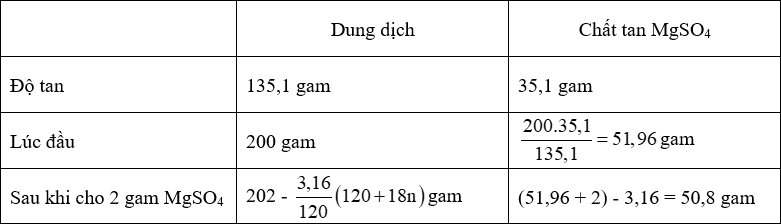
- Ta có:
+ 135,1 gam dd có chứa 35,1 gam MgSO4
+ [202 - \(\dfrac{{3,16}}{{120}}\)(120 + 18n)] gam dd có chứa 50,8 gam MgSO4.
⟹ [202 - \(\dfrac{{3,16}}{{120}}\)(120 + 18n)].35,1 = 135,1.50,8
⟹ n = 7
⟹ Công thức của tinh thể A là MgSO4.7H2O.
Làm lạnh 160 gam dung dịch bão hòa muối RSO4 30% xuống tới nhiệt độ 200C thì thấy có 28,552 gam tinh thể RSO4.nH2O tách ra. Biết độ tan của RSO4 ở 20oC là 35 gam. Xác định công thức của tinh thể RSO4.nH2O biết R là kim loại; n là số nguyên và 5 < n < 9.
Bước 1: Tính \({m_{RS{O_4}}}\) ban đầu, mdd bão hòa
- \({m_{RSO4(bd)}} = \dfrac{{30}}{{100}}.160 = 48(gam)\)
- mdd bão hòa (sau khi kết tinh) = 160 - 28,552 = 131,478 gam
Bước 2: Tính \({m_{RS{O_4}}}\) ở 20oC, \({m_{RS{O_4}}}\) trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4 = 35 gam, ta có:
mRSO4 (dd 20oC) = \(\dfrac{{35}}{{135}}.131,478 = 34,087gam\)
- Khối lượng RSO4 trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt) = mRSO4 (ban đầu) - mRSO4 (20 độ) = 48 - 34,087 = 13,913 gam
Bước 3: Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\(\dfrac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \dfrac{{R + 96}}{{18n}} = \dfrac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\)
Biện luận:
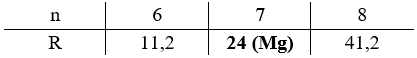
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Cần lấy bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam dung dịch CuSO4 4% để điều chế 500 gam dung dịch CuSO4 8%?
Bước 1: Đặt ẩn cho mCuSO4.5H2O; mCuSO4 4%
Gọi mCuSO4.5H2O = x (g); mdd(CuSO4 4%) = y (g).
Bước 2: Tính mCuSO4.5H2O; mCuSO4 4%
- mdd(CuSO4 8%) = mCuSO4.5H2O + mdd(CuSO4 4%)
⟹ x + y = 500 (1)
- Khối lượng CuSO4 có trong tinh thể CuSO4.5H2O là \(m = n.M = \dfrac{x}{{250}}.160 = \dfrac{{16x}}{{25}}\) (g)
Khối lượng CuSO4 có trong dung dịch CuSO4 4% là \({m_{ct}} = \dfrac{{{m_{{\rm{dd}}}}.C\% }}{{100\% }} = \dfrac{{y.4}}{{100}} = \dfrac{y}{{25}}\) (g)
Khối lượng CuSO4 có trong 500 g dung dịch CuSO4 8%: \({m_{ct}} = \dfrac{{{m_{{\rm{dd}}}}.C\% }}{{100\% }} = \dfrac{{500.8}}{{100}} = 40\) (g)
BTKL ⟹ \(\dfrac{{16x}}{{25}} + \dfrac{y}{{25}} = 40\) (2)
Từ (1)(2) ⟹ x = 100/3 ≈ 33,33 (g); y = 1400/3 ≈ 466,67 (g)
Vậy cần lấy 33,33 gam tinh thể CuSO4.5H2O và 466,67 gam dung dịch CuSO4 4% để điều chế 500 gam dung dịch CuSO4 8%.
Cho biết nồng độ dung dịch bão hòa KAl(SO4)2 ở 200C là 5,56%. Lấy m gam dung dịch bão hòa KAl(SO4)2.12H2O ở 20oC để đun nóng cho bay hơi 200 gam nước, phần còn lại làm lạnh đến 200C. Tính khối lượng tinh thể KAl(SO4)2.12H2O kết tinh?
Bước 1: Tính số mol KAl(SO4)2.12H2O kết tinh
- Gọi x là số mol KAl(SO4)2.12H2O kết tinh.
- Vì nhiệt độ không đổi nên độ tan cũng không đổi do đó nồng độ dung dịch bão hòa không đổi.
- Giả sử không thoát hơi nước thì 200 gam nước sẽ hòa tan tối đa x mol KAl(SO4)2.12H2O được dung dịch bão hòa ở 20oC.
- Phương trình nồng độ dung dịch bão hòa:
\(C\% = \dfrac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% = \dfrac{{258x}}{{474x + 200}}.100\% = 5,56\%\)
→ x = 0,048.
Bước 2: Tính mKAl(SO4)2.12H2O
- mKAl(SO4)2.12H2O = 0,048.474 = 22,75 gam.
Pha chế 35,8 gam dung dịch CuSO4 bão hòa ở 100oC. Đun nóng dung dịch này cho đến khi có 17,86 gam nước bay hơi, sau đó để nguội đến 20oC. Tính số gam tinh thể CuSO4.5H2O kết tinh. Biết rằng độ tan của CuSO4 trong nước ở 20oC và 100oC lần lượt là 20,26 gam và 75,4 gam.
Bước 1: Tính khối lượng chất tan CuSO4 trong 35,8 gam dd CuSO4 bão hòa ở 100oC
- Ở 100oC, độ tan của CuSO4 là 75,4 gam
0 Tức trong 175,4 gam dung dịch bão hòa có 75,4 gam CuSO4 và 100 gam H2O
⟹ 35,8 gam ⟶ 15,4 gam CuSO4
Gọi x là số mol CuSO4.5H2O kết tinh
Bước 2: Tính khối lượng tinh thể CuSO4.5H2O
- Ở 20oC, độ tan của CuSO4 là 20,26 gam
- Tức trong 120,26 gam dung dịch bão hòa có 20,26 gam CuSO4 và 100 gam H2O
Theo đề: (35,8 - 17,86 - 250x) gam (15,4 - 160x) gam
⟹ 120,26.(15,4 - 160x) = 20,26.(35,8 - 17,86 - 250x)
⟹ x = 0,105
⟹ mCuSO4.5H2O = 0,105.250 = 26,25 gam.
Cho 0,25 mol MgO tan hoàn toàn trong một lượng vừa đủ dung dịch H2SO4 25% đun nóng, sau đó làm nguội dung dịch đến 10oC. Tính khối lượng tinh thể MgSO4.7H2O đã tách ra khỏi dung dịch, biết rằng độ tan của MgSO4 ở 100C là 28,2 gam.
Bước 1: Tính mH2SO4 và mH2O sau phản ứng
PTHH: MgO + H2SO4 → MgSO4 + H2O
0,25 → 0,25 0,25 0,25 mol
mH2SO4 = 0,25.98 = 24,5 gam
→ Khối lượng nước sau phản ứng: \({m_{H2O}} = \dfrac{{75}}{{25}}.24,5 + 0,25.18 = 78gam\)
Bước 2: Tính mMgSO4 còn lại và mH2O còn lại
- Gọi x là số mol MgSO4.7H2O kết tinh
→ mMgSO4 còn lại = mMgSO4 ban đầu - mMgSO4 tách ra = 0,25.120 - 120x = 30 - 120x (gam)
mH2O còn lại = mH2O ban đầu - mH2O tách ra= 78 - 7x.18 = 78 - 126x (gam)
Bước 3: Tính mMgSO4.7H2O
- Ta có phương trình độ tan của MgSO4 ở 100C là:
\(S = \dfrac{{30 - 120x}}{{78 - 126x}} \times 100 = 28,2\) → x = 0,09476 mol
→ mMgSO4.7H2O = 0,09476.246 = 23,31 gam.
Nhiệt phân muối kẽm nitrat sau một thời gian thu được chất rắn và thấy khối lượng chất rắn giảm 27 gam so với lượng ban đầu. Lượng khí thu được hòa tan vào 4 lít nước thu được dung dịch axit có pH = x. Giá trị x là
Bước 1: Tính nZn(NO3)2
Giả sử nZn(NO3)2 = a mol
Ta có: Zn(NO3)2 → ZnO + 2NO2 + 0,5O2
a → 2a 0,5a
Ta có: mchất rắn giảm = mNO2 + mO2
⟹ 46.2a + 0,5a.32 = 27
⟹ a = 0,25 mol
⟹ nNO2 = 0,5 mol; nO2 = 0,125 mol
Bước 2: Tính giá trị pH.
2NO2 + 0,5O2 + H2O → 2HNO3
0,5 0,125 → 0,5
⟹ CM HNO3 = n : V = 0,5 : 4 = 0,125 (M)
⟹ [H+] = 0,125 M (do HNO3 là chất dễ tan và điện li mạnh)
⟹ pH = -log(0,125) = 0,9.
Xác định độ tan của FeSO4 trong nước ở 250C biết rằng ở nhiệt độ này khi hòa tan hết 166,8 gam muối ngậm nước FeSO4.7H2O trong 300 gam H2O thì thu được dung dịch bão hòa.
Bước 1: Tính mFeSO4 và mdd FeSO4
- nFeSO4.7H2O = 166,8/278 = 0,6 mol = nFeSO4
- mFeSO4 = 0,6.152 = 91,2 gam
- Khi cho muối ngậm nước vào 300 gam H2O thì ta có:
mH2O = 300 + 0,6.7.18 = 375,6 gam
Bước 2: Tính độ tan
- Theo đề bài, 375,6 gam H2O hòa tan 91,2 gam FeSO4
⟹ 100 gam H2O hòa tan 24,28 gam FeSO4
Vậy độ tan của FeSO4 ở 25oC là 24,28 gam.
Nhiệt phân hoàn toàn 70 gam hỗn hợp Fe(NO3)2 và AgNO3 thu được chất rắn X. Hòa tan hết chất rắn X cần 63 gam HNO3 thu được khí NO2 (là sản phẩm khử duy nhất). Khối lượng Fe(NO3)2 trong hỗn hợp ban đầu là
Bước 1: Tính số mol mỗi muối
- Đặt nFe(NO3)2 = a mol; nAgNO3 = b mol
⟹ mhỗn hợp = 180a + 170b = 70 (1)
- PTHH: 2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2
a → 0,5a
AgNO3 → Ag + NO2 + 0,5O2
b → b
- Chất rắn X gồm Fe2O3 (0,5a mol) và Ag (b mol).
+ Khi cho chất rắn X phản ứng với HNO3:
+ PTHH: Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,5a → 3a
Ag + 2HNO3 → AgNO3 + NO2 + H2O
b → 2b
⟹ nHNO3 = 3a + 2b = 1 (2)
Từ (1) và (2) ⟹ a = b = 0,2 mol
Bước 2: Tính khối lượng Fe(NO3)2
Theo PTHH, nFe(NO3)2 = 0,2 mol ⟹ mFe(NO3)2 = 36 gam.
Muối Mohr là một muối kép ngậm 6 phân tử nước được tạo thành từ hỗn hợp đồng mol sắt(II) sunfat ngậm 7 phân tử nước và amoni sunfat khan.
FeSO4.7H2O + (NH4)2SO4 → FeSO4.(NH4)2SO4.6H2O + H2O
Cho độ tan của muối Mohr ở 200C là 26,9 g/100 g H2O và ở 800C là 73,0 g/100g H2O. Tính khối lượng của muối sắt(II) sunfat ngậm 7 nước cần thiết để tạo thành dung dịch muối Mohr bão hòa 800C, sau khi làm nguội dung dịch này xuống 200C để thu được 100 gam muối Mohr tinh thể và dung dịch bão hòa. Giả thiết trong quá trình kết tinh nước bay hơi không đáng kể.
Bước 1: Tính m muối Mohr còn lại và m dung dịch còn lại
- Đặt x là số mol muối Mohr có trong dung dịch bão hòa ở 800C
→ mmuối Mohr = mFeSO4.(NH4)2SO4.6H2O = 392x (g)
Ở 800C cứ 73 gam muối Mohr tan được trong 100 gam nước để tạo thành 173 gam dd bão hòa
→ 392x gam muối Mohr tan được trong 100 gam nước để tạo thành 928,9863x gam dd bão hòa
- Khi làm nguội dung dịch từ 800C xuống 200C thì tách ra 100 gam muối Mohr tinh thể
→ Khối lượng muối Mohr còn lại trong dung dịch = 392x - 100 (g)
→ Khối lượng dung dịch còn lại = 928,9863x - 100 (g)
Bước 2: Tính x mol muối Mohr
- Ta có:
Ở 200C cứ 26,9 gam muối Mohr tan trong 100 gam nước tạo thành 126,9 gam dd bão hòa
→ 392x - 100 gam muối Mohr tan trong 100 gam nước tạo thành 928,9863x - 100 gam dd bão hòa
→ 26,9.(928,9863x - 100) = 126,9.(392x - 100)
→ x = 0,404 (mol)
→ mmuối Mohr = 0,404 × 392 = 158,368 (g)
Bước 3: Tính m muối FeSO4.7H2O
- \({m_{F{\rm{eS}}{{\rm{O}}_4}.7{H_2}O}} = 0,404 \times 278 = 112,312\left( g \right)\)
Để xác định hàm lượng FeCO3 trong quặng xiđerit, người ta làm như sau: Cân 0,6 gam mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn độ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2 ml. Phần trăm theo khối lượng của FeCO3 là
Bước 1: Tính nKMnO4
\({n_{KMn{O_4}}} = 0,025 \times 25,{2.10^{ - 3}} = 6,{3.10^{ - 4}}\left( {mol} \right)\)
Bước 2: Tính nFeSO4
- Phản ứng chuẩn độ:
Theo PTHH: \({n_{F{\rm{eS}}{{\rm{O}}_4}}} = 5{n_{KMn{O_4}}} = 5 \times 6,{3.10^{ - 4}} = 3,{15.10^{ - 3}}\left( {mol} \right)\)
Bước 3: Tính %mFeCO3
- Bảo toàn nguyên tố Fe: \({n_{F{\rm{e}}C{{\rm{O}}_3}}} = {n_{F{\rm{eS}}{{\rm{O}}_4}}} = 3,{15.10^{ - 3}}\left( {mol} \right)\)
⟹ \({m_{F{\rm{e}}C{{\rm{O}}_3}}} = 3,{15.10^{ - 3}} \times 116 = 0,3654\left( g \right)\)
⟹ \(\% {m_{F{\rm{e}}C{{\rm{O}}_3}}} = \dfrac{{0,3654}}{{0,6}}.100\% = 60,9\% \)
Hãy xác định khối lượng tinh thể MgSO4.6H2O tách khỏi dung dịch khi hạ nhiệt độ 1642 gam dung dịch bão hòa MgSO4 ở 800C xuống 200C. Biết độ tan của MgSO4 ở 80oC là 64,2 gam và ở 20oC là 44,5 gam.
Bước 1: Tính mH2O và mMgSO4 để tạo thành 1642 gam dd bão hòa.
- Ở 800C, SMgSO4 = 64,2 gam
- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòa
a gam H2O hòa tan b gam MgSO4 tạo thành 1642 gam dung dịch bão hòa
→ a = 1642.100/164,2 = 1000 gam; b = 64,2.1642/164,2 = 642 gam
- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol
⟹ Khối lượng H2O tách ra: 108x (g)
Khối lượng MgSO4 tách ra: 120x (gam)
Bước 3: Tính khối lượng tinh thể MgSO4.6H2O kết tinh
- Ở 200C, SMgSO4 = 44,5 gam
- Ta có phương trình: \(\dfrac{{642 - 120x}}{{1000 - 108x}} = \dfrac{{44,5}}{{100}}\)
Giải ra x = 2,7386 mol
- Khối lượng MgSO4 .6H2O kết tinh: 228.2,7386 = 624,4 gam.
Hòa tan hoàn toàn 7,2 gam FeO với một lượng vừa đủ dung dịch H2SO4 nồng độ 24,5% thu được dung dịch A. Làm lạnh dung dịch A xuống đến 50C thì tách ra được m gam chất rắn (FeSO4.7H2O). Dung dịch còn lại có nồng độ 12,18%. Tính khối lượng m đã tách ra ở trên.
Bước 1: Tính mdd H2SO4
- nFeO = 7,2/ 72 = 0,1 mol
FeO + H2SO4 → FeSO4 + H2O
0,1 0,1 0,1 0,1 (mol)
- mH2SO4 = 0,1.98 = 9,8 gam
→ mdd H2SO4 = \(\dfrac{{9,8.100}}{{24,5}}\) = 40 (gam)
Bước 2: Tính số mol FeSO4.7H2O kết tinh
- Gọi x là số mol FeSO4.7H2O kết tinh
→ mFeSO4 còn lại = mFeSO4 ban đầu - mFeSO4 tách ra
= 0,1.152 - 152x = 15,2 - 152x (gam)
mdd sau = mFeO + mdd H2SO4 ban đầu - mFeSO4.7H2O kết tinh
= 7,2 + 40 - 278x = 47,2 - 278x (gam)
- Ta có nồng độ % của dung dịch còn lại là:
\(C\% = \dfrac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}} \times 100\%\)
→ \(\dfrac{{15,2 - 152x}}{{47,2 - 278x}}.100\% = 12,18\% \)
→ x = 0,08 mol
Bước 3: Tính m chất rắn FeSO4.7H2O.
mFeSO4.7H2O = 0,08.278 = 22,24 gam.
Cho biết độ tan của NaNO3 trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3 bão hòa từ 50oC xuống 200C thì có bao nhiêu gam tinh thể NaNO3 tách ra khỏi dung dịch?
Bước 1: Tính mNaNO3 và mH2O trong 642gam dd bão hòa NaNO3
- Theo đề: SNaNO3 (50oC) = 114 gam, ta có:
Cứ 214 gam dung dịch bão hòa NaNO3 thì có 114 gam NaNO3 và 100 gam H2O
Vậy 642 gam dung dịch bão hòa NaNO3 thì có x gam NaNO3 và y gam H2O
→ x = mNaNO3 = 114.642/214 = 342 gam
y = mH2O = 642 – 342 = 300 gam (không đổi)
Bước 2: Tính mNaNO3 trong 300 gam H2O
- Ở 200C: SNaNO3 (20oC) = 88 gam, ta có:
Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3
Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3
Bước 3: Tính mNaNO3 tách ra khỏi dung dịch.
- mNaNO3 kết tinh = mNaNO3 (500C) - mNaNO3 (200C) = 342 – 264 = 78 gam.
Cho biết độ tan của NaNO3 trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3 bão hòa từ 50oC xuống 200C thì có bao nhiêu gam tinh thể NaNO3 tách ra khỏi dung dịch?
Bước 1: Tính mNaNO3 và mH2O trong 642gam dd bão hòa NaNO3
- Theo đề: SNaNO3 (50oC) = 114 gam, ta có:
Cứ 214 gam dung dịch bão hòa NaNO3 thì có 114 gam NaNO3 và 100 gam H2O
Vậy 642 gam dung dịch bão hòa NaNO3 thì có a gam NaNO3 và b gam H2O
→ a = mNaNO3 = 114.642/214 = 342 gam
b = mH2O = 642 – 342 = 300 gam (không đổi)
Bước 2: Tính mNaNO3 trong 300 gam H2O
- Ở 200C: SNaNO3 (20oC) = 88 gam, ta có:
Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3
Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3
Bước 3: Tính mNaNO3 tách ra khỏi dung dịch
- mNaNO3 kết tinh = mNaNO3 (500C) - mNaNO3 (200C)
mNaNO3 kết tinh = 342 – 264 = 78 gam.
Dung dịch bão hòa NaNO3 ở 10oC có nồng độ 44,44%. Tính độ tan của dung dịch NaNO3 ở 10oC.
Độ tan của NaNO3 là:
\(S = \dfrac{{C\% }}{{100 - C\% }}.100 = \dfrac{{44,44}}{{100 - 44,44}}.100 = 80(g)\).

