Để hòa tan hết 5,46 gam Fe cần ít nhất V (ml) dung dịch hỗn hợp H2SO4 0,3M và Fe(NO3)3 0,04M. Biết(sản phẩm khử N+5 là NO duy nhất). Giá trị của V là
nFe = 5,46 : 22,4 = 0,0975 (mol)
nH2SO4 = 0,3V (mol) ; nFe(NO3)3 = 0,04V (mol)
=> nH+ = 0,6V (mol) ; nNO3- =0,12V (mol) ; nFe3+ = 0,04V (mol)
Vì cần ít nhất V (ml) dung dịch nên Fe phản ứng sẽ lên Fe2+
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Ta thấy: nH+ = 0,6V > 4nNO3- = 0,48V. Nên tại thời điểm NO3- hết thì H+ vẫn còn dư một lượng là
nH+ dư = 0,6V - 0,48V = 0,12V (mol) => còn có phản ứng tạo H2
Fe + 2Fe3+ → 3Fe2+
Fe + 2H+ → Fe2+ + H2
Bảo toàn e ta có: 2nFe = 3nNO + nH+ dư + nFe3+
=> 2.0,0975 = 3.0,12V + 0,12V + 0,04V
=> V = 0,375 (l) = 375 (ml)
Cho Fe phản ứng với dung dịch H2SO4 đặc, sau phản ứng thu được khí mùi trứng thối. Khí đó là
Khí mùi trứng thối là H2S (xem lại phần lí thuyết kim loại tác dụng với axit có tính oxi hóa)
Cho Al tác dụng với dung dịch H2SO4 đặc, nóng, sau phản ứng thu được dung dịch muối và sản phẩm khử X. X có thể là
Các sản phẩm khử của H2SO4 đặc là H2S, S, SO2 (xem lại phần lí thuyết kim loại tác dụng với axit có tính oxi hóa)
Cho các kim loại sau: Al, Cu, Mg, Fe, Zn, K. Số kim loại phản ứng được với cả dung dịch H2SO4 loãng và H2SO4 đặc nguội ?
Các kim loại đứng sau H trong dãy hoạt động hóa học thì không tác dụng với H2SO4 loãng => loại Cu
Al, Fe không tác dụng với H2SO4 đặc nguội
Cho viên Mg tác dụng với HNO3, sau phản ứng không thấy có khí sinh ra. Hệ số cân bằng của HNO3 trong phản ứng là
Phản ứng không sinh ra khí => sản phẩm khử là muối NH4NO3
$4\overset{0}{\mathop{Mg}}\,\text{ }+\text{ }10H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\text{}4\overset{+2}{\mathop{Mg}}\,{{\left( N{{O}_{3}} \right)}_{2}}+\text{ }\overset{3}{\mathop{N}}\,{{H}_{4}}N{{O}_{3}}+\text{ }3{{H}_{2}}O$
$\begin{align} & 4\text{x} \\ & \\ & 1\text{x} \\ \end{align}$$\left| \begin{align} & \overset{0}{\mathop{Mg}}\,\to \overset{+2}{\mathop{Zn}}\,+2e \\ & \overset{+5}{\mathop{N}}\,+8e\to \overset{-3}{\mathop{N}}\,{{H}_{4}}N{{O}_{3}} \\ \end{align} \right.$
Cho nhôm tan hoàn toàn trong dung dịch HNO3 loãng, nóng thu được khí N2O. Sau khi đã cân bằng, số nguyên tử Al bị oxi hóa và số phân tử HNO3 bị khử là
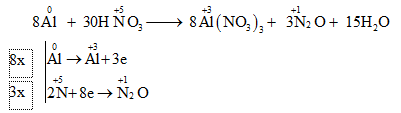
=> số nguyên tử Al bị oxi hóa là 8
Số phân tử HNO3 bị khử là 3.2 = 6
Cho sắt tan hoàn toàn trong dung dịch HNO3 loãng, nóng thu được khí N2. Sau khi đã cân bằng số phân tử HNO3 bị khử và số nguyên tử Fe bị oxi hóa là
$10\overset{0}{\mathop{Fe}}\,\text{ }+\text{ 3}6H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\text{10}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{}{{\overset{0}{\mathop{3N}}\,}_{2}}+\text{ 18}{{H}_{2}}O$
$\begin{align} & 10\text{x} \\ & \\ & 3\text{x} \\ \end{align}$$\,\,\left| \begin{align} & \overset{0}{\mathop{Fe}}\,\to \overset{+3}{\mathop{Fe}}\,+3e \\ & \overset{+5}{\mathop{N}}\,+10e\to {{\overset{0}{\mathop{N}}\,}_{2}} \\ \end{align} \right.$
=> số nguyên tử Fe bị oxi hóa là 10
=> Số phân tử HNO3 bị khử là 3.2 = 6
Cho 9,75 gam Zn tan hoàn toàn trong dung dịch HNO3 loãng, sau phản ứng thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V là
\(Zn \to \mathop {Zn}\limits^{ + 2} + 2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} O\)
0,15 → 0,3 0,3 →0,1
=> VN2O = 0,1.22,4 = 2,24 lít
Cho 1 lượng Cu phản ứng hết với dung dịch H2SO4đặc nóng dư, sau phản ứng thu được 2,24 lít khí SO2 (đktc) và m gam muối khan. Giá trị của m là
nSO2 = 0,1 mol => ne nhận = 2nSO2 = 0,2 mol
=> nCu = necho / 2 = ne nhận / 2 = 0,1 mol
\({n_{SO_4^{2 - }}} = {{{n_{e{\rm{ }}cho}}} \over 2}\) = 0,1 mol
=> mmuối = mCu + mSO4 = 0,1.64 + 0,1.96 = 16 gam
Cho 7,68 gam kim loại R tan hoàn toàn trong dung dịch HNO3 đặc, nóng, dư thu được 5,376 lít khí NO2 (đktc). Kim loại R là
nNO2 = 0,24 mol
Áp dụng bảo toàn electron: n.nR = nNO2→\(n.{{7,68} \over {{M_R}}} = 0,24\,\, \to \,\,{M_R} = 32n\)
=> R là Cu
Để hoàn tan hoàn toàn 5,4 gam Al cần dùng 200 ml dung dịch HNO3 (lấy dư 25% so với lượng cần thiết), thu được khí NO (sản phẩm khử duy nhất). Nồng độ mol của dung dịch HNO3 đã dùng là
nAl = 0,2 mol
Bảo toàn e: 3nAl = 3nNO => nNO = 0,2 mol
=> nHNO3 phản ứng = 4nNO = 4.0,2 = 0,8 mol
HNO3 lấy dư 25% => nHNO3 ban đầu = 0,8.1,25 = 1 mol
=> CM HNO3 = 1 / 0,2 = 2M
Hoàn tan 6,72 gam kim loại M trong H2SO4 đặc nóng dư, thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong 2 lít dung dịch NaOH 0,18 M, sau phản ứng đem cô cạn dung dịch thu được 22,68 gam chất rắn. M là kim loại
nNaOH = 0,36 mol
ta thấy : \({{22,68} \over {0,18}} = 126 = {M_{N{a_2}S{O_3}}}\)=> chất rắn thu được chỉ gồm Na2SO3
Bảo toàn S: nSO2 = nNa2SO3 = 0,18 mol
Bảo toàn e: n.nM = 2nSO2 =>\(n.{{6,72} \over M} = 2.0,18\,\, \to \,\,M = {{56} \over 3}n\)
=> kim loại M là Fe
Cho 28 gam Fe vào dung dịch chứa 1,3 mol H2SO4 đặc nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi các phản ứng xảy ra hoàn toàn thu được
nFe = 0,5 mol
Giả sử Fe tạo 2 muối FeSO4 ( x mol) và Fe2(SO4)3 (y mol)
Bảo toàn Fe: x + 2y = 0,5 (1)
ne nhận = ne cho = 2x + 2.3y = 2x + 6y
=> \({n_{SO_4^{2 - }}} = {n_{S{O_2}}} = {{{n_{e{\rm{ }}cho}}} \over 2}\)= x + 3y
Bảo toàn nguyên tố S: nH2SO4 = nSO4 + nSO2 => 1,3 = x + 3y + x + 3y (2)
Từ (1) và (2) => x = 0,2; y = 0,15
Vậy sau phản ứng thu được 0,2 mol FeSO4 và 0,15 mol Fe2(SO4)3
Cho 16,8 gam sắt vào dung dịch HNO3 loãng nóng thấy có V lít khí NO (đktc, sản phẩm khử duy nhất) thoát ra và sau phản ứng còn lại 5,6 gam sắt chưa tan. Giá trị của V là
Phản ứng còn lại 5,6 gam Fe không tan => có 16,8 – 5,6 = 11,2 gam Fe phản ứng, thu được Fe(NO3)2
nFe phản ứng = 0,2 mol
Bảo toàn e: 2nFe = 3nNO => nNO = 0,133 mol
=> VNO = 0,133.22,4 = 2,987 lít
Cho 28 gam Fe phản ứng với 1 lít dung dịch HNO3 1,6 M thu được dungdịch X và khí NO (sản phẩm khử duy nhất của N+5). Biết các phản ứng xảy ra hoàn toàn, khối lượng muối trong dung dịch X là
nFe = 0,5 mol; nHNO3 = 1.1,6 = 1,6 mol
Giả sử tạo thành 2 muối Fe(NO3)2 x mol và Fe(NO3)3 y mol
Bảo toàn nguyên tố Fe: nFe = nFe(NO3)2 + nFe(NO3)3 => x + y = 0,5 (1)
Ta có: nHNO3 = 4nNO => nNO = 1,6 / 4 = 0,4 mol
Bảo toàn e: 2nFe(NO3)2 + 3nFe(NO3)3 = 3nNO => 2x + 3y = 0,4.3 (2)
Từ (1) và (2) => x = 0,3 và y = 0,2 mol
=> mmuối = mFe(NO3)2 + mFe(NO3)3 = 102,4 gam
Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch HCl dư sau khi phản ứng kết thúc thu được 3,36 lít khí H2 (đktc). Nếu cho m gam hỗn hợp X trên tác dụng với HNO3 đặc nguội dư, sau phản ứng thu được 2,24 lít khí NO2 (đktc). Giá trị của m là
X + HCl => chỉ có Fe phản ứng
nFe =nH2 = 0,15 mol
X + HNO3 đặc nguội => chỉ có Cu phản ứng
nNO2 = 0,1 mol
Bảo toàn e: 2nCu = nNO2 => nCu = 0,1 / 2 = 0,05 mol
=> m = mFe + mCu = 0,15.56 + 0,05.64 = 11,6 gam
Cho 15 gamhỗn hợp (Fe, Cu, Al) tác dụng hoàn toàn với lượng dư axit H2SO4 đặc nóngđược 0,4 mol SO2 là sản phẩm khử duy nhất. Khối lượng muối tạo thành là
Ta có :\({n_{SO_4^{2 - }}} = {n_{S{O_2}}} = {{{n_{e{\rm{ }}cho}}} \over 2}\)= 0,4 mol
=> khối lượng muối tạo thành là: mmuối = mkim loại + mSO4 = 15 + 0,4.96 = 53,4 gam
Hòa tan hết hỗn hợp X gồm 6,72 gam Fe ; 5,4 gam Al và 10,8 gam Ag tác dụng với H2SO4 đặc nóng dư chỉ thoát ra khí SO2 (sản phẩm khử duy nhất của S). Số mol H2SO4 đã tham gia phản ứng là
nFe = 0,12 mol; nAl = 0,2 mol; nAg = 0,1 mol
Ta có:\({n_{SO_4^{2 - }}} = {n_{S{O_2}}} = {{{n_{e{\rm{ }}cho}}} \over 2} = {{0,12.3 + 0,2.3 + 0,1.1} \over 2} = 0,53\,\,mol\)
Bảo toàn nguyên tố S: \({n_{{H_2}S{O_4}}} = {\rm{ }}{n_{S{O_2}}} + {\rm{ }}{n_{SO_4^{2 - }}}\) = 0,53.2 = 1,06 mol
Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,4 mol Fe và 0,2 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO) là
HNO3 cần dùng ít nhất để hòa tan hỗn hợp khi tạo thành muối Fe(II)
Bảo toàn e: ne cho = 2nFe + 2nCu = 3nNO => nNO = 0,4 mol
Ta có: nNO3 = ne cho = 1,2
Bảo toàn nguyên tố N: nHNO3 = nNO3 + nNO = 1,2 + 0,4 = 1,6 mol
=> VHNO3 = 1,6 lít
Sử dụng đột biến đa bội lẻ cho những loài cây nào sau để nâng cao năng suất?
1.Ngô. 2. Đậu tương. 3. Củ cải đường. 4. Đại mạch. 5. Dưa hấu. 6. Nho.
Các cây ứng dụng đa bội lẻ để tăng năng suất là các cây không thu hạt: 3,5,6

