Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 7,99% về khối lượng) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 3: 2: 7 và 0,784 lít khí H2(đktc). Cho Y tác dụng với dung dịch gồm 0,02 mol Al2(SO4)3, 0,01 mol H2SO4 và 0,04 mol KHSO4 thu được m gam kết tủa. Giá trị của m là:
Qui đổi hỗn hơp thành Na (3u mol) ; K (2u mol) ; Ba (7u mol) và O (v mol)
(Vì sau khi cho vào nước thu được nNaOH: nKOH: nBa(OH)2 = 3: 2: 7 = 3u: 2u: 7u)
Bảo toàn electron: nNa + nK + 2nBa = 2nO + 2nH2
=> 3u + 2u + 2.7u = 2v + 0,035.2
Lại có: %mO = 7,99% => 16v = 7,99%.(23.3u + 39.2u + 137.7u + 16v)
Giải hệ PT => u = 0,01 ; v = 0,06 mol
=> nOH = 2v + 0,035.2 = 0,19 mol
nH+ = 2nH2SO4 + nKHSO4 = 2.0,01 + 0,04 = 0,06 mol
nAl3+ = 2nAl2(SO4)3 = 0,04 mol
=> nAl(OH)3 = 4nAl3+ - (nOH – nH+)
=> nAl(OH)3 = 0,03 mol
nBa2+ = 0,07 mol và nSO4 = 0,11 mol
=> nBaSO4 = nBa = 0,07 mol
=> mrắn = mBaSO4 + mAl(OH)3 = 18,65g
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba và Al2O3 vào nước được dung dịch Y. Nhỏ từ từ V lít dung dịch H2SO4 0,3M vào Y. Đồ thị mô tả sự phụ thuộc giữa khối lượng kết tủa vào V như sau:
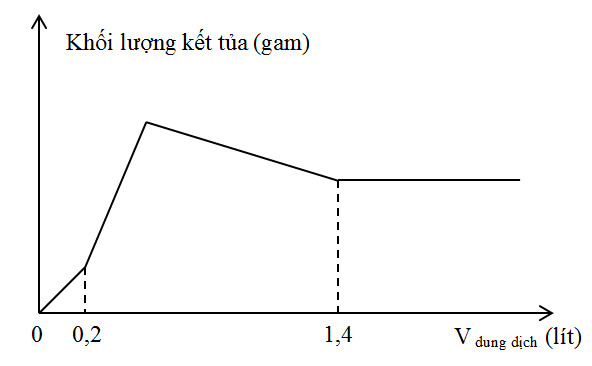
Giá trị của m là
Giả sử hỗn hợp X gồm Ba (x mol) và Al2O3 (y mol)
=> Dung dịch Y gồm: Ba2+ (x mol); AlO2- (2y mol) và OH-
BTĐT => 2nBa2+ = nAlO2- + nOH- => 2x = 2y + nOH- => nOH- = 2x - 2y
+ Tại V = 0,2 lít thì OH- vừa bị trung hòa hết:
nH2SO4 = 0,06 mol => nH+ = 0,12 mol
=> nOH- = nH+ => 2x - 2y = 0,12 (1)
+ Tại V = 1,4 lít thì Al(OH)3 bị hòa tan hết:
nH2SO4 = 0,42 mol => nH+ = 0,84 mol
nH+ = nOH- + 4nAlO2- => 0,84 = 0,12 + 4.2y (2)
Giải (1) và (2) được x = 0,15 và y = 0,09
=> m = 0,15.137 + 0,09.102 = 29,73 gam
Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x là?
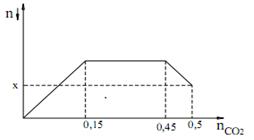
Quan sát đồ thị ta thấy nCO2 = 0,15 thì kết tủa đạt max.
=> nCa(OH)2 = nCaCO3 max = 0,15
Khi nCO2 = 0,45 thì bắt đầu hòa tan kết tủa.
Khi nCO2 = 0,5 thì lượng kết tủa bị hòa tan là: nCaCO3 bị hòa tan = 0,5 - 0,45 = 0,05
=> nCaCO3 còn lại = x = 0,15 - 0,05 = 0,1
Hỗn hợp X gồm Mg, Al, Al(NO3)3 và MgCO3 (trong đó oxi chiếm 41,618% về khối lượng). Hòa tan hết 20,76 gam X trong dung dịch chứa 0,48 mol H2SO4 và x mol HNO3, kết thúc phản ứng thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 56,28 gam và 4,48 lít (đktc) hỗn hợp khí Z gồm CO2, N2, H2. Cho dung dịch NaOH dư vào Y, thu được 13,34 gam kết tủa. Giá trị của x là
nMg = nMg(OH)2 = 0,23
Dung dịch Y chứa Mg2+ (0,23 mol), Al3+ (a mol), NH4+ (b mol), SO42- (0,48 mol)
Bảo toàn điện tích => 3a + b + 0,23 . 2 = 0,48 . 2
m muối = 27a + 18b + 0,23.24 + 0,48.96 = 56,28
=> a = 0,16 và b = 0,02
Trong X: \({{n}_{O}}~=0,54;\text{ }{{n}_{CO_{3}^{2-}}}=u\text{ ;}\,{{n}_{NO_{3}^{-}}}=v\)
mX = 0,16 . 27 + 0,23 . 24 + 60u + 62v = 20,76
nO = 3u + 3v = 0,54
=> u = 0,12 và v = 0,06
Đặt y, z là số mol N2 và H2 trong Z
nZ = 0,12 + y + z = 0,2 (1)
Bảo toàn N => 0,06 + x = 0,02 + 2y (2)
nH+ = x + 0,96 = 12y + 2z + 0,02 . 10 + 0,12 . 2 (3)
(1),(2),(3) => x = 0,04; y = 0,04; z = 0,04
Hòa tan hoàn toàn m gam hỗn hợp Al và Mg trong V ml dung dịch HNO3 2,5 M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí gồm N2 và N2O có tỉ khối so với oxi là 31:24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ dưới đây:
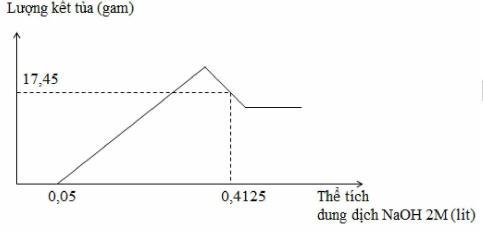
Giá trị của m và V lần lượt là
Theo quy tắc đường chéo tính được N2: 0,014 mol và N2O : 0,07 mol
Đặt nAl = x mol nMg = y mol
Dd X có dư HNO3 nên Al và Mg phản ứng hết
Al → Al+3 + 3e 2N+5 + 10e → N2
Mg → Mg+2 + 2e 2N+5 + 8e → 2N+1
Bảo toàn e thì 3x + 2y = 0,014.10 +0,07.8 = 0,7
Cho NaOH vào NaOH + HNO3 → NaNO3 + H2O → HNO3 dư :0,1 mol
Tại thể tích NaOH là 0,4125 lít thì kết tủa qua vị trí cực đại → Al(OH)3 bị hòa tan một phần
2OH- + Mg2+ → Mg(OH)2
3OH- + Al3+ → Al(OH)3
Al(OH)3 + OH- → AlO2- +H2O
Kết tủa có Mg(OH)2 : y mol, Al(OH)3 : (x – z) mol (giả sử z mol Al(OH)3 bị hòa tan)
Ta có
17,45 = 58y + 78(x - z) = m↓
2y + 3x + z = (0,4125 - 0,05).2 = nNaOH
→ x = 0,1 mol ; y = 0,2 mol; z = 0,025 mol
→ m = 27x + 24y = 7,5
Bảo toàn N trong phản ứng X + HNO3 có
nHNO3 = 3x + 2y + 2nN2 + 2nN2O + nHNO3 dư = 0,968
→ V = 0,3872 lít
Thực hiện phản ứng nhiệt phân nhôm hỗn hợp Al và Fe3O4 (trong điều kiện không có không khí thu được 234,75 gam chất rắn X. Chia X thành hai phần:
Cho phần 1 tác dụng với dung dịch NaOH dư thu được 1,68 lít khí H2 ở đktc và m gam chất rắn. Hòa tan hết m gam chất rắn vào dung dịch H2SO4 đặc nóng thu được dung dịch chứa 82,8 gam muối và 0,6 mol SO2 là sản phẩm khử duy nhất.
Hòa tan hết phần 2 trong 12,97 lít dung dịch HNO3 1M, thu được hỗn hợp khí Y (gồm 1,25 mol NO và 1,51 mol NO2) và dung dịch A chứa các chất tan đều là muối, trong đó có a mol Fe(NO3)3. Biết các phản ứng hoàn toàn. Giá trị của a gần đúng với giá trị nào sau đây?
Phần 1:
nH2 = 0,075 => nAl dư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x → 3x → 4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400.u/2 + 152v = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2 mol), Al2O3 (0,8 mol) và Fe (1,8 mol)
=> nO = 0,8 . 3 = 2,4
\({{n}_{{{H}^{+}}}}=12,97=4{{n}_{NO}}+2{{n}_{N{{O}_{2}}}}+2{{n}_{O}}+10{{n}_{NH_{4}^{+}}}=>{{n}_{NH_{4}^{+}}}=0,015\)
Dung dịch A chứa Fe3+ (a mol), Fe2+ (b mol) và các ion khác
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Cho hỗn hợp A gồm m gam các chất Al2O3 và Al vào 56,5 gam dung dịch H2SO4 98%, thu được 0,336 lít khí SO2 thoát ra (đktc) cùng dung dịch B và a gam hỗn hợp rắn D. Lọc lấy D và chia làm 2 phần bằng nhau:
+ Phần 1: Cho tác dụng với dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch X chỉ chứa muối sunfat cùng 1,4 lít (đktc) hỗn hợp khí không màu có khối lượng là 2,05 gam, có khí hóa nâu trong không khí. Dẫn từ từ đến dư dung dịch NaOH 1M vào X, thấy lượng NaOH dùng hết tối đa là 130 ml.
+ Phần 2: Nung trong không khí đến khối lượng không đổi thu được rắn Y có khối lượng giảm 1,36 gam so với lượng rắn đem đốt. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=> 3x + 6z = 2y + 0,15 + 0,1 + 8t (1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=> t + 3x = 2z (2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13 (3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=> 1,36 = 32z – 16.(1,5x – y) (4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84 gam
Hòa tan hoàn toàn 7,98g hỗn hợp gồm Mg và Al trong dung dịch chứa a mol H2SO4, sau khi kết thúc phản ứng thu được 8,96 lit khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, sự phụ thuộc số mol kết tủa và thể tích dung dịch NaOH 1M được cho như trong đồ thị sau :
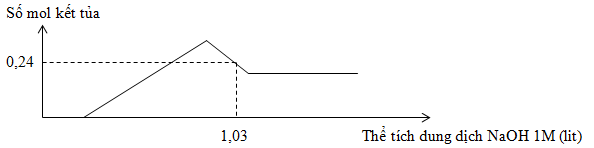
Giá trị của a là
Sau 1 thời gian thêm NaOH thì mới có kết tủa => H+ dư
Bảo toàn e : 2nMg + 3nAl = 2nH2 = 0,8 mol
Và : mMg + mAl = 7,98g
=> nMg = 0,13 ; nAl = 0,18 mol
Tại thời điểm nkết tủa = 0,24 mol thì kết tủa đang tan dần
=> nkết tủa = nMg(OH)2 + [4nAl3+ - (nOH - nH+ - 2nMg(OH)2) ]
=> 0,24 = 0,13 + [4.0,18 – (1,03 – nH+ - 2.0,13)]
=> nH+ = 0,16 mol
=> a = ½ . 0,16 + nH2 = 0,48
Cho m gam hỗn hợp K và Ba vào một lượng nước dư thu được dung dịch X và V lít khí (đktc). Sục từ từ đến dư khí CO2 vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị như sau:
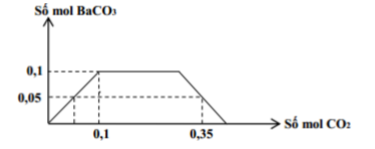
Khối lượng của K có trong m gam hỗn hợp là
Gọi nBa = x mol; nK = y mol
Ba + 2H2O → Ba(OH)2 + H2
x x x
2K + 2H2O → 2KOH + H2
y y 0,5y
=> nOH- = 2x + y
PT tạo kết tủa: Ba2+ + CO32- → BaCO3 ↓
Nhìn vào đồ thị ta thấy nkết tủa max = nBa2+ = x = 0,1 mol (1)
Xét \({{n}_{C{{O}_{2}}}}\) = 0,35 mol, khi đó nkết tủa = 0,05 mol = \({{n}_{CO_{3}^{2-}}}\)
Khi đó:
CO2 + 2OH- → CO32- + H2O
0,05 ← 0,1 ← 0,05
nCO2 còn lại = 0,35 – 0,05 = 0,3 mol sẽ có phản ứng:
CO2 + OH- → HCO3-
0,3 → 0,3
=> nOH- = 0,4 = 2x + y (2)
Từ (1) và (2) => x = 0,1 và y = 0,2
=> mK = 7,8
Cho m gam hỗn hợp X gồm Ba, BaO, Ba(OH)2 có cùng số mol vào nước, thu được 500 ml dung dịch Y và a mol H2. Hấp thụ từ từ 3,6a mol CO2 vào 500 ml dung dịch Y, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
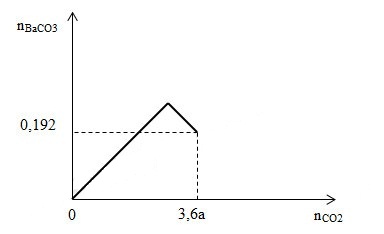
Giá trị của m là
nH2 = nBa = nBaO = nBa(OH)2 => Ba(OH)2 sau pư = 3a mol
Tại nCO2 = 3,6a mol
BaCO3: 0,192 mol
Ba(HCO3)2: 3a - 0,192
BTNT C: 0,192 + 2.(3a - 0,192) = 3,6a => a = 0,08 mol
m = 0,08.137 + 0,08.153 + 0,08.171 = 36,88 gam
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2. Sục khí CO2 dư vào Y, thu được 46,8 gam kết tủa. Cho Z tan hết vào dung dịch HNO3 , thu được dung dịch chứa 146,52 gam muối nitrat và 12,992 lít NO (là sản phẩm khử duy nhất của HNO3). Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa Al dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Hỗn hợp X gồm Al, Ca, Al4C3 và CaC2. Cho 40,3 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốy cháy hết Z thu được 20,16 lít khí CO2 (đktc) và 20,7 gam H2O. Nhỏ từ từ V lít dung dịch HCl xM vào Y, được kết quả biểu diễn theo hình vẽ
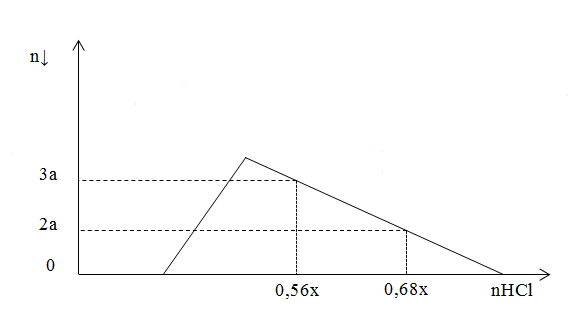
Giá trị x gần nhất với:
nC = nCO2 = 0,9 mol
nH = 2nH2O = 2,3 mol
Quy đổi hỗn hợp X: Al x mol; Ca y mol; C: 0,9 mol
Quy đổi hỗn hợp Z: C: 0,9 mol; H: 2,3 mol
.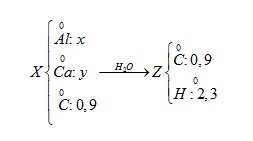
27x + 40y + 12.0,9 = 40,3
3x + 2y = 2,3 (BT e)
=> x = 0,5; y = 0,4
=> Y gồm Ca(AlO2)2: 0,25 mol và Ca(OH)2: 0,4 - 0,25 = 0,15 mol (BTNT Ca)
\({{n}_{HCl}}-2{{n}_{Ca{{\left( OH \right)}_{2}}}}=4{{n}_{AlO_{2}^{-}}}~-\text{ }3{{n}_{\downarrow }}\)
=> 0,56x - 0,3 = 4.0,5 - 3.3a (1)
=> 0,68x - 0,3 = 4.0,5-3.2a (2)
(1) và (2) => x = 2,5; a = 0,1
Dẫn từ từ khí CO2 vào dung dịch chứa đồng thời Ba(OH)2 và NaAlO2. Sự phụ thuộc của khối lượng kết tủa y (gam) vào thể tích khí CO2 tham gia phản ứng (x lít, đktc) được biểu thi bằng đồ thị sau:
Giá trị của m là
Tại thời điển VCO2 = a lít thì
Ba(OH)2 + CO2 → BaCO3 + H2O
0,15 → 0,15 mol
→ a = 3,36 lít
Tại thời điển VCO2 = b lít thì
Ba(OH)2 + CO2 → BaCO3 + H2O
0,15 → 0,15 mol
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
→ mAl(OH03 = 37,35 – 29,55 = 7,8 g → nAl(OH)3 = 0,1 mol
→ b = 0,25.22,4 = 5,6 lít
Tại thời điểm VCO2= a + b – 1,68 = 7,28 lít → nCO2 = 0,325 mol
Khi đó xảy ra các phản ứng sau :
Ba(OH)2 + CO2 → BaCO3 + H2O
0,15 → 0,15 mol
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
0,1 0,1
BaCO3 + CO2 + H2O → Ba(HCO3)2
0,075 0,075
→mkết tủa = mBaCO3 + mAl(OH)3 = 0,075.197 + 0,1.78 = 22,575 g
Cho m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước dư, thu được dung dịch X và 0,672 lít khí H2 ở đktc. Chia dung dịch X thành 2 phần bằng nhau:
+ Phần 1 cho tác dụng với dung dịch CuSO4 dư thu được 8,09 gam kết tủa.
+ Phần 2 hấp thụ hết 1,344 lít CO2 thu được 1,97 gam kết tủa.
Giá trị của m là
Cho m gam hỗn hợp tác dụng với nước dư thu được 0,03 mol H2
=> Cho m/2 gam hỗn hợp tác dụng với nước dư thu được 0,015 mol H2
Quy đổi hỗn hợp thành Na, Ba, O
Giả sử m/2 (gam) hỗn hợp có: Na (x mol); Ba (y mol) và O (z mol)
+ Hòa tan vào nước:
BT electron: nNa + 2nBa = 2nO + 2nH2 => x + 2y = 2z + 2.0,015 (1)
+ Phần 1 tác dụng với CuSO4 dư:
Phần 1 của dung dịch X chứa: Na+ (x mol); Ba2+ (y mol) và OH-
BTĐT => nOH- = nNa+ + 2nCa2+ = x + 2y (mol)
Cu2+ + 2OH- → Cu(OH)2
x + 2y → 0,5x + y
Ba2+ + SO42- → BaSO4
y → y
=> m kết tủa = mCu(OH)2 + mBaSO4 => 98(0,5x + y) + 233y = 8,09 (2)
+ Phần 2 hấp thụ hết 0,06 mol CO2 thu được 0,01 mol BaCO3: nBaCO3 < nCO2 => có tạo muối HCO3-
BTNT "C": nHCO3- = nCO2 - nCO32- = 0,06 - 0,01 = 0,05 mol
Dung dịch thu được gồm: Na+ (x mol); Ba2+ (y-0,01 mol) và HCO3- (0,05 mol)
BTĐT: nNa+ + 2nBa2+ = nHCO3- => x + 2(y-0,01) = 0,05 (3)
Giải hệ (1) (2) (3) được x = 0,03; y = 0,02; z = 0,02
=> m = 2(23x + 137y + 16z) = 7,5 gam
Cho m gam hỗn hợp X gồm Na, Ca tan hết trong dung dịch Y chứa 0,08 mol NaHCO3 và 0,04 mol CaCl2. Sau phản ứng thu được 7g kết tủa và thấy thoát ra 0,896 lit khí (dktc). Giá trị của m là :
nNaHCO3 = 0,08 mol ; nCaCl2 = 0,04 mol
nCaCO3 = 7 : 100 = 0,07 mol = nCa2+ = nCa + nCaCl2 (Bảo toàn nguyên tố Ca)
=> nCa = 0,07 – 0,04 = 0,03 mol
- Các phản ứng của kim loại khi thả vào nước :
Na + H2O → NaOH + ½ H2
Ca + 2H2O → Ca(OH)2 + H2
=> nH2 = 0,896 : 22,4 = 0,04 mol = ½ nNa + nCa => nNa = 2.(0,04 – 0,03) = 0,02 mol
=> m = mNa + mCa = 23.0,02 + 40.0,03 = 1,66g
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,06 mol khí H2 và dung dịch X. Hấp thụ hết 0,128 mol khí CO2 vào dung dịch X, thu được dung dịch Y (chỉ chứa các muối) và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau:
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,24M thấy thoát ra 0,03 mol khí CO2.
+ Nếu cho từ từ 200 ml dung dịch HCl 0,24M vào phần 2 thấy thoát ra 0,024 mol khí CO2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Do lượng CO2 thu được ở 2 thí nghiệm khác nhau mặc dù lượng HCl như nhau nên X chứa CO32-, HCO3- và Na+
+ Phần 1: Cho từ từ CO32-, HCO3- vào H+ thì phản ứng xảy ra đồng thời theo đúng tỉ lệ về số mol (vì ban đầu H+ rất dư)
CO32- + 2H+ → H2O + CO2
x ← 2x → x
HCO3- + H+ → H2O + CO2
y ← y → y
=> nCO2 = x + y = 0,03 mol; nH+ = 2x + y = 0,24.0,2
Giải hệ thu được x = 0,018 và y = 0,012
=> nCO32- : nHCO3- = 0,018 : 0,012 = 3 : 2
+ Phần 2: Đặt nCO32- = 3a (mol) và nHCO3- = 2a (mol)
Cho từ từ H+ vào hỗn hợp CO32- và HCO3- thì phản ứng xảy ra theo thứ tự:
CO32- + H+ → HCO3-
3a → 3a → 3a
HCO3- + H+ → CO2 + H2O
0,024 ← 0,024
=> nH+ = 3a + 0,024 = 0,048 => a = 0,008
Vậy 1/2 dung dịch Y gồm: CO32- (0,024 mol), HCO3- (0,016 mol)
=> dd Y gồm: CO32- (0,048 mol), HCO3- (0,032 mol) và Na+ (0,128 mol) (theo BTĐT)
BTNT "C": nCO2 = nCO32-(Y) + nHCO3- (Y) + nBaCO3 => 0,128 = 0,048 + 0,032 + nBaCO3
=> nBaCO3 = 0,048 mol => nBa (hh) = nBaCO3 = 0,048 mol
nNa(hh) = nNa+ = 0,128 mol
BT electron: nNa + 2nBa = 2nO + 2nH2 => 0,128 + 2.0,048 = 2nO + 2.0,06 => nO = 0,052
=> m = mNa + mBa + mO = 0,128.23 + 0,048.137 + 0,052.16 = 10,352 gam
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K, Na2O, Ba và BaO (trong đó oxi chiếm 20% khối lượng) vào nước, thu được 200 ml dung dịch Y và 0,896 lít H2. Trộn 200 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,4M và H2SO4 0,3M thu được 400 ml dung dịch có pH = 13. Coi H2SO4 phân li 2 nấc hoàn toàn. Giá trị của m là
Bước 1: Tính nOH-pư
- nHCl = 0,08 mol và nH2SO4 = 0,06 mol ⟹ nH+ = 0,2 mol
- Vì pH > 7 nên OH- dư, H+ hết ⟹ nOH- (pư) = nH+ = 0,2 mol
Bước 2: Tính nOH-pư
- Mặt khác pH = 13 ⟹ [OH-] dư = 0,1 ⟹ nOH- dư = 0,04 mol
⟹ nOH- (Y) = 0,2 + 0,04 = 0,24 mol
Bước 3: Tính mX
- Mà ta có công thức nhanh: nOH- (Y) = 2nH2 + 2nO ⟹ 0,24 = 2.0,04 + 2.nO ⟹ nO = 0,08 mol
⟹ mX = 0,08.16.(100/20) = 6,4 gam.
Hỗn hợp X gồm Al, Ba, Al4C3 và BaC2. Cho 29,7 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy hết Z, thu được 4,48 lít CO2 (đktc) và 9,45 gam H2O. Nhỏ từ từ 120ml dung dịch H2SO4 1M vào Y, thu được m gam kết tủa. Giá trị của m là
Bước 1: Tính nO khi đốt cháy Z
- nCO2 = 0,2 mol ; nH2O = 0,525 mol
- BTNT O: nO = 2nCO2 + nH2O = 0,925 mol
Bước 2: Tính nBa, nAl
- Quy đổi 15,15 gam hỗn hợp X thành Ba (a mol), Al (b mol), C (0,2 mol)
- Xét quá trình đốt hỗn hợp khí Z, ta có hệ sau:
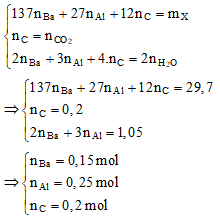
Bước 3: Tính m gam kết tủa
- Dung dịch Y gồm Ba2+ (0,15 mol), AlO2- (0,25 mol) và OH-.
- BTĐT: ${n_{O{H^ - }}} = 2{n_{B{a^{2 + }}}} - {n_{Al{O_2}^ - }} = 0,05\,mol$
- Cho 0,12 mol H2SO4 tác dụng với dung dịch Y: ${n_{Al{O_2}^ - }} > {n_{{H^ + }}} - {n_{O{H^ - }}}$
⇒${{\text{n}}_{{\text{Al(OH}}{{\text{)}}_{\text{3}}}}}{\text{ = }}{{\text{n}}_{{{\text{H}}^{\text{ + }}}}}{\text{ - }}{{\text{n}}_{{\text{O}}{{\text{H}}^{\text{ - }}}}}{\text{ = 0,19}}\;{\text{mol}}$ và BaSO4: 0,12 mol ⇒ mkết tủa = 42,78 (g)

