Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là
Vì dung dịch thu được có phản ứng với Fe rạo khí NO nên dung dịch có H+ và NO3-
Tại A có 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e
0,2 mol → 0,2 mol e y mol
Tại K có Cu2+ + 2e → Cu
Bảo toàn e có nCu = ( 0,2 + 4y) : 2
→ khối lượng của dung dịch giảm là mdd giảm = ( 0,2 + 4y) : 2 .64 + 0,1.71 + y.32 = 21,5
→ y = 0,05 mol → nCu = 0,2 mol
Dung dịch thu được sau phản ứng có : Cu2+ (x – 0,2) mol ; H+ : 0,2 mol; NO3- : 2x, Na+ : 0,1 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 4H2O + 2NO
Cu2+ + Fe → Fe2+ + Cu
→mthanh giảm = 64.(x-0,2) – 56 .(x – 0.2 + \(\frac{3}{8}\) .0,2) = -1,8 → x = 0,5
Điện phân hỗn hợp 0,2 mol NaCl và a mol Cu(NO3)2 sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 29,5 gam. Cho thanh sắt vào dung dịch X đến phản ứng hoàn toàn thấy khối lượng thanh sắt giảm 6,8 gam và thoát ra khí NO duy nhất. Tính a?
dd sau khi điện phân có phản ứng với Fe sinh ra khí NO → dd sau khi điện phân phải chứa HNO3
→ Cl- phải điện phân hết, bên anot đã có H2O bị điện phân
Catot (quá trình khử) Anot (quá trình oxi hóa)
Cu2+ → Cu + 2e 2Cl- + 2e → Cl2
0,2→ 0,2 → 0,1 (mol)
2H2O + 4e → 4H+ + O2
4b ← 4b ← b (mol)
Đặt nO2 = b (mol)
→ ne(nhận) = nCl- + 4nO2 = 0,2 + 4b (mol)
→ nCu = ne(nhận)/2 = 0,1 + 2b (mol)
Ta có: mdd giảm = mCu + mCl2 + mO2
→ 29,5 = 64(0,1 + 2b) + 0,1.71 + 32b
→ 16 = 160b → b = 0,1 (mol)
Vậy dd X thu được sau pư gồm:
nH+ = 4b = 0,4 (mol); nCu2+ dư: a – 0,1 (mol); NO3-; Na+
Cho dd X pư với Fe xảy ra pư:
PTHH: 3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO↑ + 4H2O (1)
0,15← 0,4 (mol)
Fe + Cu2+ → Fe2+ + Cu↓ (2)
(a-0,1) ← (a – 0,1) → (a – 0,1) (mol)
∑nFe pư (1) + (2) = 0,15 + a – 0,1
= 0,05 + a (mol)
nCu sinh ra(2) = (a – 0,1) (mol)
Ta có: mFe giảm = mFe pư – mCu sinh ra
→ 6,8 = 56.(0,05 + a) – 64(a – 0,1) → 8a = 2,4 → a = 0,3
Điện phân dung dịch X chứa 0,03 mil Fe2(SO4)3 và 0,02 mol CuSO4 trong 4632 giây với dòng điện một chiều có cường độ I = 2,5A. Biết hiệu suất điện phân là 100%. Khối lượng dung dịch giảm sau khi điện phân là
ne trao đổi = 2,5.4632 : 96500 = 0,12 mol
Tại catot : Fe+3 + 1e → Fe+2
0,06 0,06 0,06 mol
Cu+2 + 2e → Cu
0,02 0,04 0,02 mol
Fe+2 + 2e → Fe
0,01 0,02 0,02 mol
Tại anot : 2H2O → 4H+ + 4e + O2
0,12 →0,03 mol
=> mdung dịch giảm = mCu + mFe + mO2 = 0,02.64 + 0,01.56 + 0,03.32 = 1,28 +0,56 + 0,96 = 2,8 gam
Điện phân dung dịch X gồm Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2,5A. Sau t giây, thu được 7,68 gam kim loại ở catot, dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối hơi so với H2 bằng 25,75. Mặt khác, nếu điện phân X trong thời gian 12352 giây thì tổng số mol khí thu được ở hai điện cực là 0,11 mol. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Số mol ion Cu2+ trong Y là
*t giây: nCu = 0,12 mol
Catot: Cu2+ điện phân chưa hết
Cu2+ + 2e → Cu
0,24 ← 0,12
Anot: Cl- bị điện phân hết, H2O đã bị điện phân
Áp dụng đường chéo ta có:
Cl2: 71 19,5
51,5 => nCl2 = nO2
O2: 32 19,5
Cl- → 0,5Cl2 + 1e
x → 2x
H2O → 2H+ + 0,5O2 + 2e
x → 4x
ne = 2x + 4x = 0,24 => x = 0,04 mol
*t = 12352 giây => ne = It/F = 2,5.12352/96500 = 0,32 mol
Anot:
Cl- → 0,5Cl2 + 1e
0,04 → 0,08
H2O → 2H+ + 0,5O2 + 2e
0,06 ← 0,24
Catot: n khí (catot) = 0,11 – 0,04 – 0,06 = 0,01 mol
Cu2+ + 2e → Cu
y 2y
H2O + 1e → 0,5H2 + OH-
0,02 ← 0,01
=> ne = 2y + 0,02 = 0,32 => y = 0,15 mol
nCu2+ (Y) = 0,15 – 0,12 = 0,03 mol
Dung dịch hỗn hợp X gồm NaCl 0,6M và CuSO40,5M. Điện phân 100 ml dung dịch X (điện cực trơ, màng ngăn xốp, hiệu suất 100%, bỏ qua sự hòa tan của khí trong nước hay sự bay hơi của nước) với cường độ dòng điện không đổi 0,5A trong thời gian t giây. Dung dịch sau điện phân có khối lượng giảm 4,85 gam so với dung dịch ban đầu. Giá trị của t là
Ban đầu dung dịch X chứa nNaCl = 0,06 mol và nCuSO4 = 0,05 mol
Tại A : 2Cl- → Cl2 + 2e
Tại K thì Cu+2 +2e → Cu
Vì nCl < 2nCu nên điện phân thì Cl- hết trước
Tại thời điểm Cl- hết thì nCu = nCl : 2 = 0,06 : 2 =0,03 mol
Khi đó mdd giảm = mCl2 + mCu = 0,03.71 + 0,03.64 = 4,05 g < 4,85 g nên tại A xảy ra điện phân nước
\(2{H_2}O \to 4{H^ + } + {O_2} + 4e\)
Tại thời điểm Cu2+ bị điện phân hết thì mdd giảm = mCl2 + mCu + mO2 = 0,03.71 + 0,05.64 + mO2 = 5,33 + mO2 > 4,85
Nên Cu2+ chưa điện phân hết
Đặt nO2 = x mol thì theo bảo toàn e có nCu(2+) = (nCl- + 4nO2) : 2 = (0,06 + 4x) : 2 =0,03 + 2x (mol)
Khối lượng dung dịch sau điện phân giảm là mdd giảm = mCu + mCl2 + mO2 = (0,03 + 2x).64 + 0,03.71 + 32x = 4,85
=> x = 0,005 mol => nCu = 0,03 + 0,005.2 = 0,04 mol
=> ne trao đổi = 2nCu = \(\dfrac{{I.t}}{F} = \dfrac{{0,5.t}}{{96500}}\) = 2.0,04 =0,08 nên t = 15440 (s)
Điện phân dung dịch X chứa đồng thời 0,1 mol FeCl3 và 0,1 mol CuCl2 (điện cực trơ, màng ngăn xốp) một thời gian thì dừng lại, thấy catot tăng 3,584 gam (toàn bộ kim loại giải phóng bám trên catot). Khối lượng dung dịch X sau khi điện phân giảm là
mcatot tăng = mKL bám vào = 3,584 < mCu = 0,1.64 = 6,4 → Cu chưa điện phân hết
→ mcatot tăng = mCu sinh ra = 3,584 (g) → nCu sinh ra = 0,056 (mol)
Tại catot xảy ra pư theo thứ tự:
Fe3+ +1e → Fe2+
0,1 → 0,1 (mol)
Cu2+ + 2e → Cu
0,112 ← 0,056 (mol)
Tổng mol e nhường = 0,1 + 0,112 = 0,212 = nCl- nhận
Tại anot xảy ra quá trình:
2Cl- → Cl2 + 2e
0,106 ← 0,212 (mol)
→ Khối lượng dd giảm = mCu sinh ra + mCl2↑ = 3,584 + 0,106.71 = 11,11 (g)
Điện phân dung dịch X gồm FeCl2 và MgCl2 (có màng ngăn), sự phụ thuộc khối lượng của dung dịch X theo thời gian được biểu diễn theo đồ thị sau:
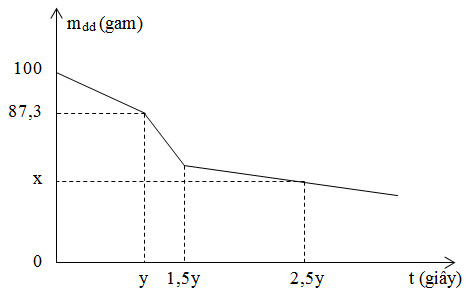
Giá trị x là
Điện phân hỗn hợp dung dịch FeCl2 và MgCl2 thì thứ tự điện phân là:
(1) FeCl2 \(\xrightarrow{{dp{\text{dd}}}}\) Fe + Cl2
(2) MgCl2 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) Mg(OH)2 + Cl2 + H2
(3) 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2H2 + O2
Từ các phương trình điện phân và đồ thị ta có thể suy ra:
+ t = [0; y] thì xảy ra (1)
(1) FeCl2 \(\xrightarrow{{dp{\text{dd}}}}\) Fe + Cl2
a a a (mol)
m dd giảm = mFe + mCl2 => 56a + 71a = 100 - 87,3 => a = 0,1 mol
=> n e (y giây) = 2nFe = 0,2 mol
+ t = [y; 1,5y] thì xảy ra (2) MgCl2 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) Mg(OH)2 + Cl2 + H2
n e (1,5y giây) = 1,5.n e (y giây) = 1,5.0,2 = 0,3 mol
Ta có: n e [y; 1,5y] = 0,3 - 0,2 = 0,1 mol
Mà n e [y; 1,5y] = 2nCl2 => nCl2 = 0,05 mol => nMgCl2 = 0,05 mol
+ t = [1,5y; 2,5y] thì xảy ra (3)
n e (2,5y giây) = 2,5.n e (y giây) = 2,5.0,2 = 0,5 mol
(1) FeCl2 \(\xrightarrow{{dp{\text{dd}}}}\) Fe + Cl2
0,1 → 0,1 → 0,1
(2) MgCl2 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) Mg(OH)2 + Cl2 + H2
0,05 → 0,05 → 0,05 → 0,05 => n e [1,5y; 2,5y] = 0,5 - 0,3 = 0,2 mol
Mà n e [1,5y; 2,5y] = 4nO2 => nO2 = 0,05 mol
(3) 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2H2 + O2
0,1 ← 0,05
=> m dd giảm = mFe(1) + mCl2(1) + mMg(OH)2(2) + mCl2(2) + mH2(3) + mO2(3)
= 0,1.56 + 0,1.71 + 0,05.58 + 0,05.71 + 0,05.2 + 0,1.2 + 0,05.32 = 21,05 gam
=> x = m dd còn lại = m dd ban đầu - m dd giảm = 100 - 21,05 = 78,95 gam
Điện phân 200 ml dung dịch hỗn hợp MgCl2 1M và NaCl 1M, với I = 2,68A, trong thời gian 3 giờ với điện cực trơ, màng ngăn xốp. Sau khi kết thúc điện phân thấy khối lượng dung dịch giảm m gam so với dung dịch ban đầu. Giá trị của m là
ne = It/F = 2,68.3.3600/96500 = 0,3 mol
nMg2+ = 0,2 mol; nCl- = 2nMgCl2 + nNaCl = 0,6 mol
Catot: Mg2+ và Na+ không bị điện phân, H2O điện phân hộ.
H2O +1e → OH- + 0,5 H2
0,3 → 0,3 → 0,15 mol
Anot: Cl- (0,6 mol)
Cl- → 0,5Cl2 + 1e
0,15 ← 0,3 mol
Chú ý còn phản ứng:
Mg2+ + 2OH- → Mg(OH)2
0,15 ← 0,3 → 0,15 (mol)
m dd giảm = mH2 + mCl2 + mMg(OH)2 = 0,15.2 + 0,15.71 + 0,15.58 = 19,65 gam
Tiến hành điện phân (với điện cực trơ, hiệu suất 100%, dòng điện có cường độ không đổi) dung dịch X gồm 0,3 mol CuSO4 và 0,225 mol HCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 21,1875 gam so với khối lượng của dung dịch X. Cho 22,5 gam bột Fe vào dung dịch Y đến khi kết thúc các phản ứng thu được m gam kim loại. Giá trị của m là
Tại A(+) thì : 2Cl- → Cl2 +2e
2 H2O → 4H+ +O2 + 4e
Tại K (-) thì Cu2+ +2e → Cu
2H+ +2e → H2
2H2O + 2e → 2OH- + H2
Nếu Cu2+ điện phân hết thì ne = 2.0,3 = 0,6 mol e → nO2 = (0,6 – 0,225) : a= 0,09375 mol
→ mdd giảm (1) = 0,3.64 + 0,225.35,5 + 0,09375.32= 30,1875 gam
Nếu chỉ có Cl- điện phân hết thì ne = 0,225 < 2nCu2+ → nCu = 0,225 : 2 =0,1125 mol
→ mdd giảm (2) = 0,1125.64 + 0,225.35,5 = 15,1875
Vì mdd giảm (2) = 15,1875 < mdd giảm = 21,1875 < mdd giảm (1) = 30,1875 gam
nên Cu2+ chưa điện phân hết tại K còn tại A điện phân cả nước và Cl-
Đặt nCu2+ điện phân = x mol thì ne = 2x
Bảo toàn e thì nO2 = (2x – 0,225) : 4 mol
Có mdd giảm = 64x + (2x – 0,225) : 4 .32 + 0,225.35,5 = 21,1875 → x = 0,1875 mol
→ dd Y thu được có nCu2+ = 0,3 – 0,1875 = 0,1125 mol; nH+ = 2x – 0,225 + 0,225 = 0,375 mol và SO42- : 0,3 mol
Y + 0,4 mol Fe thì Fe + Cu2+ → Fe2+ + Cu
0,1125 0,1125 0,1125 mol
Fe + 2H+ → Fe2+ + H2
0,1875 0,375 mol
Nên mkim loại = mFe – mFe phảnứng + mCu = 22,5 – ( 0,1125 + 0,1875).56 + 0,1125.64 = 12,9 gam
Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là
(1) 2NaCl + CuSO4 → Cu +Cl2 + Na2SO4
Ở (1) NaCl phản ứng vừa đủ với CuSO4 => Dung dịch sau điện phân chỉ có Na2SO4
Điện phân một dung dịch gồm a mol CuSO4 và b mol NaCl. Nếu b > 2a mà ở catot chưa có khí thoát ra thì dung dịch sau điện phân chứa
Catot (-) Cu2+, Na+, H2O Anot (+) SO42- , Cl-, H2O
(1) Cu2+ + 2e → Cu (1) 2Cl- → Cl2 + 2e
a → 2a → a b → b/2 → b
Vì catot chưa có khí thoát ra và b>2a => Dung dịch sau điện phân chứa: Na+, SO42-, Cu2+, Cl-.
Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là
${n_{{e_{td}}}} = \dfrac{{5.1930}}{{96500}} = 0,1 mol$
Catot gồm Ag+ và Cu2+ bị oxi hóa
Ag+ + 1e → Ag
0,04 0,04
Cu2+ + 2e → Cu
0,06 →0,03
=>$\left\{\begin{gathered}{n_{Ag}} = 0.04\,mol \\ {n_{Cu}} = \dfrac{{0,1 - 0,04}}{2} = 0,03mol \hfill \\ \end{gathered} \right. $
=> mKL= 0,04.108 + 0,03.64 = 6,24g
Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
mAg = 4,32g => mFe(bị điện phân) = 5,44 – 4,32 = 1,12g => nFe = 0,02 mol
Ag+ + 1e → Ag
0,04 0,04
Fe3++ 1e → Fe2+
0,06 0,06
Fe2+ + 2e → Fe
0,04 0,02
=> netđ= 0,04 + 0,1 = 0,14 mol
Mà ${{n}_{{{e}_{td}}}}=\dfrac{It}{F}=0,1 mol$ => $t=\dfrac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\dfrac{96500.0,14}{5,36}=2520,522s$
Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
nFe3+ = 0,2 mol ; nCu2+ = 0,05mol ; nFe2+ =0,05mol
mtăng = mCu + mFe => mFe = 8,8 – 0,05.64 = 5,6g => nFe = 0,1mol
Các ion đã điện phân ở catot: Fe3+ , Cu2+, Fe2+ điện phân 1 phần
netđ = nFe3+ + 2nCu2+ + 2nFe2+ = 0,2 + 0,05.2 + 0,1.2 = 0,5 mol
=> $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,5}{10}=4825s$
Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 > 0,02
→ Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hết
nAgNO3 = 0,08mol
Ag+ + 1e → Ag
0,08 → 0,08
Cu2+ + 2e → Cu
0,04 0,02
=> netđ= 0,04 + 0,08 = 0,12 mol
=> $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,12}{10}=1158s$
Điện phân 200 ml dung dịch hỗn hợp AgNO3 0,1 M và Cu(NO3)2 0,2 M với điện cực trơ và cường độ dòng điện bằng 5A. Sau 19 phút 18 giây dừng điện phân, lấy catot sấy khô thấy tăng m gam. Giá trị của m là:
${{n}_{{{e}_{td}}}}=\frac{It}{F}=\frac{5.1158}{96500}=0,06 mol$
nAgNO3 = 0.02 mol , nCu(NO3)2 = 0,04 mol
Ag+ + 1e → Ag
0,02....0,02
Cu2+ + 2e → Cu
0,04 →0,02
=> AgNO3 điện phân hết, Cu(NO3)2 điện phân 1 phần
mcatot tăng = 0,02.108 + 0,02.64 = 3,44g
Điện phân 200 ml dung dịch AgNO3 0,4M và Cu(NO3)2 0,2M với điện cực trơ. Sau một thời gian điện phân lấy catot ra làm khô cân lại thấy tăng m gam, trong đó có 1,28 gam Cu. Giá trị của m là
Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 > 0,02
→ Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hết
nAgNO3 = 0,08mol
Ag+ + 1e → Ag
0,08 → 0,08
Cu2+ + 2e → Cu
0,04 0,02
=> mAg = 0,08.108 = 8,64g
=> mcatot tăng = 8,64 + 0,02.64 = 9,92g
Tiến hành điện phân hoàn toàn dung dịch X chứa 200 ml dung dịch AgNO3 và Cu(NO3)2 thu được 56 gam hỗn họp kim loại ở catot và 4,48 lít khí ở anot (đktc). Nồng độ mol AgNO3 và Cu(NO3)2 trong X lần lượt là
nAgNO3 = x mol , nCu(NO3)2 = y mol
|
Catot (-) Cu2+,Ag+, H2O (1) Ag+ + 1e → Ag x → x → x (2) Cu2+ + 2e → Cu y →2y → y |
Anot (+) NO3- , H2O (1) H2O → 2H+ +1/2 O2 + 2e 0,2 → 0,8 |
m(kim loại) = 56g => 108x + 64y = 56
n(khí) = 4,48/22,4 = 0,2 mol => x + 2y = 0,8
=> x = 0,4 và y = 0,2
=> CM(AgNO3) = 2M , CM(Cu(NO3)2) = 1M
Điện phân 100 ml dung dịch CuSO4 0,2 M và AgNO3 0,1 M với cường độ dòng điện I = 3,86A. Thời gian điện phân để thu được 1,72 gam kim loại bám trên catot là:
Khi điện phân dung dịch chứa nhiều ion kim loại, ion nào có tính oxy hóa mạnh bị điện phân trước
Tính oxi hóa của Ag+ > Cu2+ nên Ag+ bị điện phân trước
(-) Ag+ + e → Ag
0,01 0,01 0,01
=> mAg = 0,01.108 = 1,08 (gam) < 1,72 (gam)
=> Cu2+ bị điện phân
Cu2+ + 2e → Cu
0,02 0,01
$n_{Cu}=\frac{1,72-1,08}{64}=0,01(mol)$
$\Rightarrow \sum{n}_{(e\,nhận)}=0,03(mol)$
$\Rightarrow n_{e}=\frac{It}{F}\Rightarrow t=\frac{0,03.96500}{3,86}=750(giây)$
Điện phân 100 ml dung dịch X gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong 579 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là:
$n_{e}=\frac{It}{F}=\frac{5.579}{96500}=0,03(mol)$
Catot: nCu2+ = 0,02 (mol)
Cu2+ + 2e → Cu
0,02 0,04
ne = 0,04 > 0,03 => Cu2+ dư
=> nCu = 0,03/2 = 0,015 (mol)
Anot: nCl- = 0,01 < 0,03 => Cl- hết, có H2O điện phân
2Cl- → Cl2 + 2e
0,01 0,005 0,01
H2O → 1/2O2 + 2H+ + 2e
0,005 0,02
=> m dung dịch giảm = mCu + mCl2 + mO2 = 0,015.64 + 0,005.71 + 0,005.32 = 1,475 (g)

