Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (trong đó số mol NaCl gấp 4 lần số mol CuSO4) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h), thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được 1,5a mol khí H2. Dung dịch Y tác dụng với bột Al dư, thu được 12a mol khí H2. Biết hiệu suất điện phân 100%, các phản ứng xảy ra hoàn toàn, các khí sinh ra không hòa tan vào nước. Phát biểu nào dưới đây đúng?
Đặt nCuSO4 = x mol và nNaCl = 4x mol
(Giả sử a = 1)
- Do khi cho Y tác dụng với Al thu được nhiều khí hơn cho X tác dụng với Al dư nên suy ra tại t (h):
|
Catot Cu2+ điện phân hết, H2O đang điện phân |
Anot Cl- chưa bị điện phân hết |
|
Cu2+ + 2e → Cu x → 2x H2O + 1e → 0,5H2 + OH- \(\xrightarrow{{ + Al}}\) 1,5H2 1 ← 1 ← 1,5 => ne (t) = 2x + 1 (mol) |
Cl- → 0,5Cl2 + 1e |
- Tại 2t (h): ne(2t) = 2ne(t) = 4x + 2 (mol) > nCl- (= 4x) => tại anot Cl- đã bị điện phân hết, H2O đang điện phân
Y chứa: Na+ (4x mol); SO42- (x mol) và OH-
BTĐT => nOH- (dd Y) = 2x (mol)
OH- → 1,5H2
2x → 3x = 12 => x = 4
=> nCu2+ = 4; nCl- = 16; ne(t) = 9
- Xét A:
ne(0,85t) = 0,85.9 = 7,65 < 2nCu2+ (= 8) => Cu2+ chưa điện phân hết => catot chưa có khí => A sai
- Xét B: ne(2t) = 18
|
Catot Cu2+ điện phân hết, H2O đang điện phân |
Anot Cl- điện phân hết, H2O đang điện phân |
|
Cu2+ + 2e → Cu 4 → 8 H2O + 1e → 0,5H2 + OH- 10 → 5 |
Cl- → 0,5Cl2 + 1e 8 ← 16 H2O → 2H+ + 0,5O2 + 2e 0,5 ← 2
|
=> n khí = 5 + 8 + 0,5 = 13,5 mol => B sai
- Xét C: ne(1,8t) = 1,8.9 = 16,2
Anot:
Cl- → 0,5Cl2 + 1e
8 ← 16
H2O → 2H+ + 0,5O2 + 2e
0,05 ← 0,2
=> nO2 = 0,05 mol => C đúng
- Xét D:
Anot:
Cl- → 0,5Cl2 + 1e
4,5 ← 9
=> nCl2 = 4,5 mol => D sai
Nếu người sinh viên đổi 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
Tại catot xảy ra bán phản ứng: Pb2+ + 2e \( \to\) Pb
Tại anot xảy ra bán phản ứng: Pb \( \to\) Pb2+ + e
Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 6,96 gam và tại catot chỉ thu được (a) gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 11,78 gam và tại catot thoát ra 0,224 lít khí (đktc). Giá trị của (a) là
Đặt hóa trị của kim loại M hóa trị x . Đặt \({x \over M}\) = k
Trong t giây quá trình xảy ra tại các điện cực
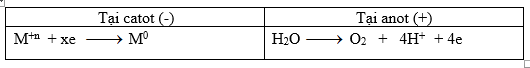
Số mol e trao đổi ta: ne trao đổi = \(x.{a \over M}\) = ka => nO2 = ka/4
Khối lượng dd giảm là 6,96 gam
→ a + 32ka/4 = 6,96
→ a + 8ka = 6,96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
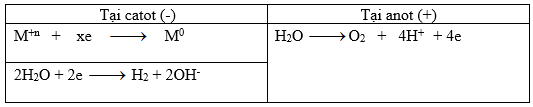
Tại catot: nH2 = 0,01 => nM = (2ka – 0,02)/x
Tại anot: nO2 = 2ka/4 = 0,5ka (mol)
→ Khối lượng dd giảm = mM + mH2 + mO2
\(\eqalign{
& \to {{2ka - 0,02} \over x}.M + 0,01.2 + 0,5ka.32 = 11,78 \cr
& \to {{2ka - 0,02} \over k} + 16ka = 11,76 \cr
& \to a - {{0,01} \over k} + 8ka = 5,88(2) \cr} \)
Thế (1) vào (2) \(6,96 - {{0,01} \over k} = 5,88 \to k = {1 \over {108}}\)
Ta có:\(k = {x \over M} \to {x \over M} = {1 \over {108}}\)
→ Chọn x = 1 và M = 108 (Ag) thỏa mãn
Thế \(k = {1 \over {108}}\) vào (1) →\(a + 8.{1 \over {108}}a = 6,96 \to a = 6,48\,(g)\)
Giá trị pH của dung dịch thay đổi như thế nào?
+ Tại catot:
Pb \( \to\) Pb2+ + 2e
Mg \( \to\) Mg2+ + 2e
+ Tại anot:
2H2O \( \to\) O2 + 4H+ + 4e
Do H+ sinh ra ở anot nên pH của dung dịch giảm dần
Bán phản ứng nào xảy ra ở catot?
Bán phản ứng xảy ra ở catot là Pb2+ + 2e \( \to\) Pb
Bán phản ứng nào xảy ra ở anot?
Bán phản ứng xảy ra ở anot là 2H2O \( \to\) O2 + 4H+ + 4e
Bán phản ứng nào xảy ra ở anot?
Bán phản ứng xảy ra ở anot là 2H2O \( \to\) O2 + 4H+ + 4e
Số gam kim loại Al bám lên điện cực trong bình 3 là:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
\( \to\) Zn2+ và Al3+ không bị điện phân.
Số gam kim loại Zn bám lên điện cực trong bình 1 là:
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
\( \to\) Zn2+ và Al3+ không bị điện phân.
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và NaCl vào nước thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M, N).
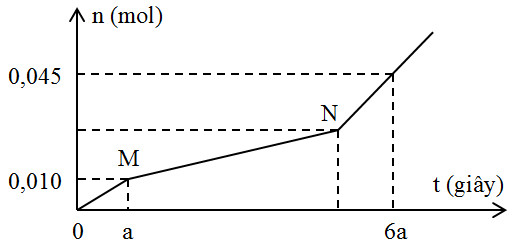
Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là
Đoạn 1: n khí = nCl2 = 0,01 mol => ne(t) = 2nCl2 = 0,02 mol
Sau mỗi a (s) thì lượng e trao đổi = 0,02 (mol)
BTNT "Cl" => nNaCl = 2nCl2 = 0,02 mol
Đoạn 2: độ dốc nhỏ hơn đoạn 1 => có thoát ra khí O2 (x mol)
Đoạn 3: thoát ra cả khí H2 và O2 => Đặt nO2 = y (mol) => nH2 = 2y (mol)
=> n khí tổng = 0,01 + x + 3y = 0,045 (1)
n e ở anot = 0,02 + 4x + 4y = 6*0,02 = 0,12 (2)
=> x = 0,02 (mol) ; y = 0,005 (mol)
* Đoạn 2: 2nCu = 2nCl2 + 4nO2 = 0,02 * 4 + 0,01 * 2 = 0,1
=> nCu = nCuSO4 = 0,05 (mol)
nNaCl = 2 nCl2 = 0,01 * 2 = 0,02 (mol)
=> m muối = 0,05 * 160 + 0,02 * 58,5 = 9,17 (gam)
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
Bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e.
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và NaCl vào nước thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M, N).
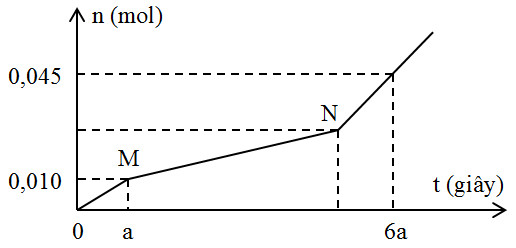
Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là
Đoạn 1: n khí = nCl2 = 0,01 mol => ne(t) = 2nCl2 = 0,02 mol
Sau mỗi a (s) thì lượng e trao đổi = 0,02 (mol)
BTNT "Cl" => nNaCl = 2nCl2 = 0,02 mol
Đoạn 2: độ dốc nhỏ hơn đoạn 1 => có thoát ra khí O2 (x mol)
Đoạn 3: thoát ra cả khí H2 và O2 => Đặt nO2 = y (mol) => nH2 = 2y (mol)
=> n khí tổng = 0,01 + x + 3y = 0,045 (1)
n e ở anot = 0,02 + 4x + 4y = 6*0,02 = 0,12 (2)
=> x = 0,02 (mol) ; y = 0,005 (mol)
* Đoạn 2: 2nCu = 2nCl2 + 4nO2 = 0,02 * 4 + 0,01 * 2 = 0,1
=> nCu = nCuSO4 = 0,05 (mol)
nNaCl = 2 nCl2 = 0,01 * 2 = 0,02 (mol)
=> m muối = 0,05 * 160 + 0,02 * 58,5 = 9,17 (gam)
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) V lít dung dịch X chứa đồng thời R(NO3)2 0,45M (R là kim loại hóa trị không đổi) và NaCl 0,4M trong thời gian t giây, thu được 6,72 lít hỗn hợp khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch chứa KOH 0,75M và NaOH 0,5M không sinh ra kết tủa. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V là
Do Y tác dụng với kiềm nên R2+ có bị điện phân
nR(NO3)2 = 0,45V mol; nNaCl = 0,4V mol
*t giây: Thu được hỗn hợp khí ở anot nên Cl- bị điện phân hết, H2O đã bị điện phân
nCl2 = 0,5nNaCl = 0,2V mol
n khí = nCl2 + nO2 => nO2 = 0,3 – 0,2V (mol)
=> n e (t giây) = 2nCl2 + 4nO2 = 2.0,2V + 4(0,3-0,2V) = 1,2-0,4V (mol)
*2t giây: n e (2t giây) = 2,4-0,8V
Trong t giây tiếp theo nO2 sinh thêm = (1,2-0,4V)/4 = 0,3-0,1V (mol)
=> ∑nO2 = 0,6-0,3V (mol)
DD Y phản ứng với NaOH và KOH không sinh ra kết tủa nên có các TH sau:
- TH1: R2+ bị điện phân hết: ne ≥ 2nR2+ => 2,4-0,8V ≥ 2.0,45V => V ≤ 24/17
Catot:
R2+ + 2Cl- → R + Cl2
0,2V ← 0,4V
R2+ + H2O → R + 2H+ + 0,5O2
0,25V → 0,5V
H2O → H2 + O2
nOH- = nH+ => 0,5V = 0,5 => V = 1 (thỏa mãn)
- TH2: R2+ điện phân chưa hết, OH- phản ứng với H+ và R2+ tạo R(OH)2 sau đó hòa tan R(OH)2
ne < 2nR2+ => 2,4-0,8V < 2.0,45V => V > 24/17
nR2+ bị đp = ne : 2 = 1,2-0,4V => nR2+ dư = 0,85V-1,2
nH+ = 4nO2 = 2,4-1,2V
=> nOH- = nH+ + 4nR2+ => 0,5 = 2,4-1,2V + 4(0,85V-1,2) => V = 1,318 (không thỏa mãn)
Tiến hành điện phân V lít dung dịch chứa Cu(NO3)2 1M và NaCl 0,5M (điện cực trơ) đến khi khối lượng dung dịch giảm m gam thì dừng điện phân. Cho 9,5g Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 1,12 lít khí NO thoát ra(sản phẩm khử duy nhất) và còn lại 5,7 gam hỗn hợp rắn không tan. Giá trị của m gần nhất với giá trị nào sau đây:
Quá trình điện phân:
Catot: Cu2+ + 2e → Cu
Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
(Vì dung dịch sau điện phân + Fe tạo NO => sản phẩm điện phân có H+, không còn Cl-)
- Sau phản ứng thu được hỗn hợp kim loại => Fe và Cu
(nNO = 1,12: 22,4 = 0,05 mol)
3Fe + 8H+ + 2NO3- → Fe2+ + 2NO + 4H2O (Vì Fe dư nên chỉ tạo được Fe2+)
Mol 0,075 0,2 ¬ 0,05
Vì sau phản ứng không còn Cl- => dung dịch chỉ gồm Cu(NO3)2 , NaNO3 và HNO3
Fe + Cu2+ → Fe2+ + Cu
Mol x → x
=> mFe bđ - mrắn = mFe pứ - mCu
=> 9,5 – 5,7 = 56.(0,075 + x) – 64x => x = 0,05 mol
=> Bảo toàn N: 2nCu(NO3)2 bđ = 2nCu(NO3)2 sau + nHNO3 + nNaNO3 (mà nNaNO3 = nNaCl = ½ nCu(NO3)2 bđ)
=> 1,5nCu(NO3)2 bđ = ½ (2.0,05 + 0,2) = 0,2 mol
=> nCu2+ bị đp = 0,2 – 0,05 = 0,15 mol
Bảo toàn electron: 2nCu = nH+ + 2nCl2 => nCl2 = ½ (0,15.2 – 0,2) = 0,05 mol
=> mgiảm = mCu + mCl2 + mO2 = 64.0,15 + 71.0,05 + 32.0,05 = 14,75g (gần nhất với giá trị 14,7g)
Trong thí nghiệm 2, khối lượng kim loại Zn bám lên điện cực trong bình 1 là:
Bước 1: Xác định kim loại bị điện phân trong thí nghiệm
Điện phân dung dịch có thể điều chế các kim loại hoạt động trung bình hoặc yếu (các kim loại đứng sau Al trong dãy điện hóa) bằng cách điện phân dung dịch muối của chúng.
→ Zn2+ và Ag+ bị điện phân; Al3+ không bị điện phân.
Bước 2: Viết các bán phản ứng xảy ra ở catot
Catot của bình 1 (-): Zn2+ + 2e → Zn
⟹ ne trao đổi (1) = 2.nZn
Catot của bình 2 (-): Ag+ + 1e → Ag
⟹ ne trao đổi (2) = nAg = \(\frac{{3,24}}{{108}}\) = 0,03 mol
Bước 3: Tính khối lượng Zn bám lên điện cực trong bình 1
Do 3 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
⟹ ne trao đổi (1) = ne trao đổi (2) ⟹ 2.nZn = 0,03 ⟹ nZn = 0,015 mol
Khối lượng Zn bám lên điện cực trong bình 1 là: mZn = 0,015.65 = 0,975 gam
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào?
Khi điện phân đồng thời dung dịch hỗn hợp chứa Pb(NO3)2 và Mg(NO3)2:
- Mg(NO3)2 không bị điện phân
- Pb(NO3)2 bị điện phân theo phản ứng:
2Pb(NO3)2 + 2H2O → 2Pb + O2 + 4HNO3
Ta thấy H+ (HNO3) sinh ra ở anot nên pH của dung dịch giảm dần.
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
Bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e.
Điện phân dung dịch hỗn hợp NaCl và 0,05 mol CuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn). Sau thời gian t giây thì ngừng điện phân, thu được khí ở hai điện cực có tổng thể tích là 2,352 lít (đktc) và dung dịch X. Dung dịch X hòa tan được tối đa 2,04 gam Al2O3. Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là
nAl2O3 = 0,02 mol;
Đặt nNaCl = a mol
TH1: X chứa H+ => Cl- điện phân hết trước Cu2+ => a < 2nCu2+ = 0,04 mol
=> nH+ = 6nAl2O3 = 1,2 mol
Cu2+ + 2Cl- → Cu + Cl2
a →0,5a→0,5a
Cu2+ + H2O → Cu + 2H+ + 0,5O2
0,6←1,2
H2O → H2 + 0,5O2
Thấy trường hợp này vô lí vì nCu bị đp = 0,5a + 0,6 > nCu ban đầu => loại
TH2: X chứa OH- => Cu2+ điện phân hết trước Cl- => a > 2nCu2+ = 0,04 mol
nOH- = 2nAl2O3 = 0,04 mol
(1) Cu2+ + 2Cl- → Cu + Cl2
0,05 → 0,1 → 0,05
(2) Cl- + H2O → 0,5Cl2 + 0,5H2 + OH-
0,02← 0,02 ←0,04
(3) H2O → H2 + 0,5O2
x x 0,5x
Khí gồm: Cl2 (0,07 mol); H2 (x + 0,02 mol) và O2 (0,5x mol)
=> n khí = nCl2 + nH2 + nO2 = 1,5x + 0,09 = 0,105 => x = 0,01
=> n e = 2nCl2(1) + 2nH2 (2) + 2nH2 (3) = 0,05.2 + 0,02.2 + 0,01.2 = 0,16 mol
=> t = ne.F/I = 0,16.96500/2 = 7720 giây
Cho m gam tinh thể CuSO4.5H2O vào dung dịch KCl thu được dung dịch X. Tiến hành điện phân dung dịch X với điện cực trơ, màng ngăn xốp và cường độ dòng điện không đổi, ở thời gian t giây thu được dung dịch Y đồng thời ở anot thu được 0,15 mol hỗn hợp khí. Nếu thời gian điện phân là 2t giây, tổng số mol khí thoát ra ở cả hai điện cực là 0,393 mol. Nhúng thanh Mg vào dung dịch Y, kết thúc phản ứng thấy khối lượng thanh không đổi so với trước phản ứng. Giá trị của m là
Trong t giây đầu tiên, tại anot thu được Cl2 (a mol) và O2 (b mol)
=> a + b = 0,15 (1)
=> Số mol electron trao đổi trong t giây = 2a + 4b
Ban đầu đặt \({n_{CuS{O_4}}} = x\)=> trong t giây thì nCuSO4 bị đp = a + 2b => nCuSO4 dư = x – a – 2b
\({n_{{O_2}}} = b = > {n_{{H^ + }}} = 4b\)
Khi nhúng Mg vào Y, vì khối lượng thanh không đổi nên: mMg pứ = mCu bị Mg đẩy ra
=> 24.(x – a – 2b + 2b) = 64.(x – a – 2b) (2)
Sau 2t giây thì ne = 4a + 8b => nH2 = 2a + 4b – x
Khí trong 2t giây = khí trong t giây đầu (0,15 mol) + H2 + O2
=> 0,15 + (2a + 4b – x) + (a/2 + b) = 0,6 (3)
Giải hệ (1), (2), (3) => a = 0,09; b = 0,06; x = 0,282
=>\({m_{CuS{O_4}.5{H_2}O}} = 70,5\)
Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1: 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2 A. Sau thời gian điện phân t (giờ), thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 14,96 gam so với dung dịch ban đầu. Dung dịch Y phản ứng vừa hết với 2,04 gam Al2O3. Giá trị của t gần nhất với giá trị nào sau đây?
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước => dung dịch Y chứa OH-
Vì dung dịch Y chứa 2 chất tan => Y gồm NaOH và Na2SO4 => Cl- bị điện phân hết
\(A{l_2}{O_3} + 2O{H^ - }\; \to {\rm{ }}2Al{O_2}^ - + {H_2}O\)
=>\({n_{O{H^ - }}} = 2{n_{A{l_2}{O_3}}} = 0,04{\rm{ }}mol\)
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
0,04 ← 0,02 ←0,02 ← 0,04
Bảo toàn Clo => nCl = 0,02.2 + a.2= 3a
=> a = 0,04
m giảm=64.0,04+71. 0,04+71.0,02+2.0,02 = 6,86 gam <14,96
=> H2O bị điện phân: mH2O= 14,96-6,86 = 8,1gam
2H2O→ 2H2+ O2
0,45 0,45 0,225 mol
Tại anot: 0,06 mol Cl2và 0,225 mol O2
=>\({n_e} = 0,06.2 + 0,225.4 = 1,02{\rm{ }}mol \Rightarrow t = \dfrac{{{n_e}.F}}{I} = \dfrac{{1,02.96500}}{2} = 49215{\rm{(s)}} = 13,67\,(h)\)

