Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
AgNO3 : x (mol)
Cu(NO3)2 : y (mol)
Dd Y : Cu(NO3)2 : 0,5x + y (mol)
Dd Z : Fe(NO3)2 : 0,5x + y (mol)
Vì sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn nên :
2b = a + c
=>2.(0,5. x + y). 64 = 108x + 64y + (0,5x + y).56
=> 72x = 8y
=> 9x = y => x : y = 1: 9
Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
Dung dịch X chứa 2 muối nên \(AgN{{O}_{3}}\) phản ứng hết. Dung dịch X gồm
\(Zn{{(N{{O}_{3}})}_{2}}\) và \(Cu{{(N{{O}_{3}})}_{2}}\) (Trong đó \({{R}_{1}},{{R}_{2}}\) là kí hiệu chất rắn)
PTHH:
\((1)Zn+2A{{g}^{+}}\to Z{{n}^{2+}}+2Ag\)
0,05 ← 0,1 → 0,1 (mol)
\((2)Zn+C{{u}^{2+}}\to Z{{n}^{2+}}+Cu\)
0,1 ← 0,1 → 0,1 (mol)
\((3)Fe+C{{u}^{2+}}\to F{{e}^{2+}}+Cu\)
PT: 1 1 1 1 (mol) →m chất rắn ↑ = 8 gam
ĐB: x m chất rắn ↑ = 6 - 5,6 = 0,4 gam
→ \({{n}_{C{{u}^{2+}}(3)}}=x=0,05(mol)\to {{n}_{C{{u}^{2+}}(2)}}=0,15-0,05=0,1(mol)\)
\(\to {{m}_{Zn(R1)}}=26,9-0,1.108-0,1.64=9,7(g)\)
Vậy \(m={{m}_{Zn({{R}_{1}})}}+{{m}_{Zn(1)}}+{{m}_{Zn(2)}}=9,7+0,05.65+0,1.65=19,45(g)\)
Cho hỗn hợp gồm Mg (7a mol) và Fe (4a mol) vào dung dịch chứa 0,08 mol FeCl3 và 0,16 mol CuCl2, sau một thời gian thu được dung dịch X và 7,36 gam chất rắn Y. Cho dung dịch AgNO3 dư vào X, kết thúc phản ứng thu được 84,68 gam kết tủa. Nếu cho NaOH dư vào X (không có mặt oxi) thu được 24,72 gam các hiđroxit kim loại. Lấy 7,36 gam Y hòa tan trong dung dịch HNO3 loãng dư thu được 0,08 mol khí NO duy nhất và dung dịch T chứa m gam muối. Giá trị của m là
Bảo toàn điện tích => \({{n}_{O{{H}^{-}}}}={{n}_{C{{l}^{-}}}}=0,56\)
=> mkim loại trong X = 24,72 – 0,56.17 = 15,2
Bảo toàn khối lượng cho kim loại:
24.7a + 56.4a + 0,08.56 + 0,16.64 = 15,2 + 7,36 => a = 0,02
\({{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=0,56=>{{n}_{Ag}}=0,04\)
=> \({{n}_{F{{e}^{2+}}}}=0,04\)
=> mới có 0,02 mol Mg phản ứng, Fe3+ còn dư, Fe và Cu2+ chưa phản ứng
Chất rắn Y chứa:
nMg = 7a – 0,04/2 = 0,12
nFe = 4a = 0,08
Y phản ứng với HNO3, bảo toàn electron:
0,12.2 + 0,08.3 \(=3.{{n}_{NO}}+8.{{n}_{N{{H}_{4}}N{{O}_{3}}}}\) \(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,03\)
=> mmuối = 7,36 + 62.(0,12.2 + 0,08.3) + 80.0,03 = 39,52
Hỗn hợp X gồm Mg, Al, Zn. Cho 6,5 gam hỗn hợp X vào 200 ml dung dịch Ba(OH)2 0,5M và KOH 1M, kết thúc phản ứng thu được 4,256 lít khí H2 (đktc). Nếu cho 13 gam hỗn hợp X tác dụng với một lượng dung dịch H2SO4 loãng đến khi ngừng thoát khí thu được 4,032 lít H2 (đktc) và chất rắn không tan Y. Cho Y vào 200 ml dung dịch chứa AgNO3 1M và Cu(NO3)2 2M, sau khi phản ứng xảy ra hoàn toàn thu được 34,4 gam chất rắn X. Thành phần phần trăm số mol của Zn trong X là
${{n}_{Ba{{(OH)}_{2}}}}=0,1\,mol;\,{{n}_{K\text{O}H}}=0,2\,mol\Rightarrow {{n}_{O{{H}^{-}}}}=0,1.2+0,2=0,4\,mol$
Đặt a, b, c là số mol Mg, Al, Zn trong 6,5 gam X
=> 24a + 27b + 65c = 6,5 (1)
\({{n}_{O{{H}^{-}}}}=0,4\text{ }mol>\text{ 2}\text{.}{{n}_{{{H}_{2}}}}=2.0,19=0,38\) => kiềm dư, Al và Zn tan hết
=> 3b + 2c = 0,19.2 (2)
\({{n}_{A{{g}^{+}}}}=0,2\,mol;\,\,{{n}_{C{{u}^{2+}}}}=0,4\,mol\)
Nếu chỉ có Ag+ phản ứng thì mZ = mAg = 21,6
Nếu cả Ag+ và Cu2+ đều hết thì mZ = mAg + mCu = 47,2
Thực tế 21,6 < mZ < 47,2 nên Ag+ hết, Cu2+ chưa hết => Y tan hết
Bảo toàn electron cả quá trình cho 13 gam X :
\(2.{{n}_{Mg}}+3.{{n}_{Al}}+2.{{n}_{Zn}}=2.{{n}_{{{H}_{2}}}}+1.{{n}_{A{{g}^{+}}}}+2.{{n}_{C{{u}^{2+}}}}\)pứ
=> 2.(2a + 3b + 2c) = 2.0,18 + 0,2.1 + 2.nCu2+ pư
=> nCu2+ pư = 2a + 3b + 2c – 0,28
mZ = mAg + mCu = 21,6 + 64.(2a + 3b + 2c – 0,28) = 34,4 (3)
Giải hệ (1), (2), (3) => a = 0,05; b = 0,1; c = 0,04
=> %nZn = 21,05%
Cho hỗn hợp Mg và Cu tác dụng với 200 ml dung dịch chứa hỗn hợp 2 muối AgNO3 0,3M và Cu(NO3)2 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch A và chất rắn B. Cho A tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung đến khối lượng không đổi được 3,6 gam hỗn hợp X gồm 2 oxit. Hòa tan hoàn toàn B trong dung dịch H2SO4 đặc nóng thu được 2,016 lít SO2 (đktc). Phần trăm khối lượng Mg trong hỗn hợp đầu là
Ban đầu đặt a và b là số mol của Mg và Cu
\({{n}_{A{{g}^{+}}}}=0,06\text{ }mol;\text{ }{{n}_{C{{u}^{2+}}}}=0,05\text{ }mol;\text{ }{{n}_{S{{O}_{2}}}}=0,09\text{ }mol\)
Bảo toàn electron: 2a + 2b = 0,09.2 (1)
Dung dịch A chứa Mg2+ (a mol), Cu2+ và NO3- (0,16 mol)
Bảo toàn điện tích => nCu2+ = 0,08 – a (mol)
=> mX = 40a + 80.(0,08 – a) = 3,6 (2)
Từ (1) và (2) => a = 0,07 và b = 0,02
=> %mMg = 56,8%
Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây: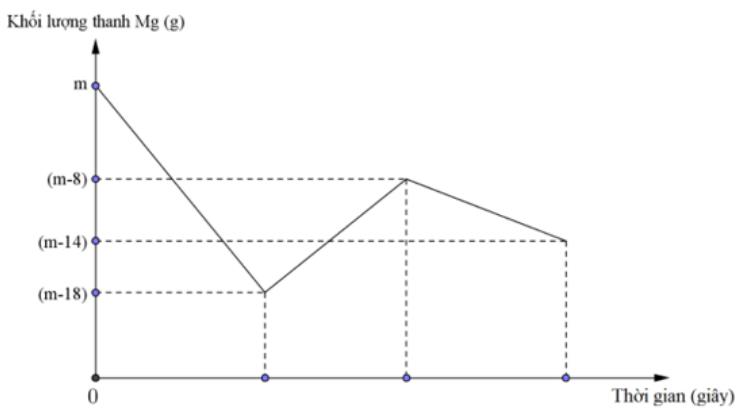
Sau khi phản ứng xảy ra hoàn toàn, rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
Đoạn 1: Khối lượng Mg giảm 18 gam (0,75 mol)
3Mg + 8H+ + 2NO3- → 3Mg2+ + 2NO + 4H2O
0,75 → 2
Đoạn 2: Khối lượng Mg tăng 18 – 8 = 10 gam
Mg + Cu2+ → Mg2+ + Cu
a a a
∆m = 64a – 24a = 10 => a = 0,25
Đoạn 3: Khối lượng Mg giảm 14 – 8 = 6 gam => nMg = 0,25 mol
Mg + 2H+ → Mg2+ + H2
0,25 → 0,5
Vậy nH+ = b = 2 + 0,5 = 2,5
=> a : b = 1 : 10
Cho 19,24 gam hỗn hợp gồm Mg, Fe, Cu vào dung dịch chứa Fe(NO3)3 0,75M và Cu(NO3)2 0,5M. Sau khi kết thúc phản ứng thu được dung dịch Y có chứa 2 muối và 20,56 gam chất rắn Z. Cho 350 ml dung dịch NaOH 1,2M vào dung dịch Y, lọc bỏ kết tủa, cô cạn dung dịch nước lọc, lấy phần rắn đem nung đến khối lượng không đổi thu được 28,11 gam chất rắn khan. Cho dung dịch HCl dư vào rắn Z thấy thoát ra 2,688 lít khí H2 (đktc). Phần trăm khối lượng của Mg có trong hỗn hợp X gần nhất với
Vì dung dịch Y chứa 2 muối => Y gồm Mg(NO3)2 và Fe(NO3)2
=> chất rắn Z gồm Cu và có thể có Fe
Y + NaOH → dd gồm NaNO3 (a mol) và NaOH dư (b mol)
=> nNaOH ban đầu = a + b = 0,42 (1)
2NaNO3 $\xrightarrow{{{t}^{o}}}$ 2NaNO2 + O2
a mol → a mol
=> mrắn = mNaNO2 + nNaOH => 69a + 40b = 28,11 (2)
Từ (1) và (2) => a = 0,39 và b = 0,03
Đặt x là thể tích dung dịch muối ban đầu
$\Rightarrow {{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}=0,75\text{x}\,(mol);\,{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}=0,5\text{x}\,(mol)$
Bảo toàn gốc NO3: $3.{{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}+2.{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}={{n}_{NaN{{\text{O}}_{3}}}}$
=> 0,75x.3 + 0,5x.2 = 0,39 => x = 0,12
Dung dịch Y chứa Mg2+ (u mol); Fe2+ (v mol) và NO3- (0,39 mol)
Bảo toàn điện tích => 2u + 2v = 0,39
Bảo toàn kim loại : \({{m}_{hh(Mg,Fe,Cu)}}+{{m}_{Fe(trong\text{ }Fe{{\left( N{{O}_{3}} \right)}_{3}})}}+{{m}_{Cu(trong\text{ }Cu{{(N{{O}_{3}})}_{2}})}}={{m}_{M{{g}^{2+}}(trongY)}}+{{m}_{F{{e}^{2+}}(trong\text{ }Y)}}+{{m}_{Z}}\)
=> 19,24 + 0,75x.56 + 0,5x.64 = 24u + 56v + 20,56
=> u = 0,105 và v = 0,09
=> \(\%{{m}_{Mg}}=\frac{24u}{19,24}.100\%=13,1\%\)
Nung m gam hỗn hợp X gồm bột Al và Fe3O4 sau một thời gian thu được chất rắn Y. Để hòa tan hết Y cần V ml dung dịch H2SO4 0,7M (loãng). Sau phản ứng thu được dung dịch Z và 9,846 lít khí (đo ở 1,5atm; 270C). Cho dung dịch NaOH vào dung dịch Z đến dư, thu được kết tủa M. Nung M trong chân không đến khối lượng không đổi thu được 44 gam chất rắn T.
Cho 50 gam hỗn hợp X1 gồm CO và CO2 qua ống sứ đựng chất rắn T nung nóng. Sau khi T phản ứng hết thu được hỗn hợp khí X2 có khối lượng gấp 1,208 lần khối lượng của X1.
Giá trị của m và V lần lượt là:
Giả sử T chứa x mol oxit FeO và y mol Fe2O3 (hiđroxit nhôm tan trong kiềm)
=> mT = 72x + 160y = 44 gam
Khi cho X1 vào T thì khí đi ra X2 tăng khối lượng chính là do oxi trong oxit chuyển vào:
CO + O → CO2
=> mO = 16.(x + 3y) = 1,208.50 – 50 = 10,4 gam
=> x = 0,5 mol; y = 0,05 mol
=> Z có 0,5 mol Fe2+ và 0,1 mol Fe3+
=> ${{n}_{F{{e}_{3}}{{O}_{4}}\left( X \right)}}=\frac{0,6}{3}=0,2~mol$
=> Fe3O4 dư => nFe3O4 dư = $0,5.{{n}_{F{{\text{e}}^{3+}}}}$ = 0,05 mol
=> Al có thể còn dư
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
0,4 ← 0,15 → 0,2 → 0,45
nH2 = 0,6 mol
=> Al dư => nAl dư $=\frac{0,6-0,45}{1,5}=0,1\,mol$
=> nAl ban đầu = 0,1 + 0,4 = 0,5 mol
=> m = 0,5.27 + 0,2.232 = 59,9 gam
=> ${{n}_{{{H}_{2}}S{{O}_{4}}}}={{n}_{Fe}}+4.{{n}_{F{{e}_{3}}{{O}_{4}}}}+1,5.\left( {{n}_{Al}}+2.{{n}_{A{{l}_{2}}{{O}_{3}}}} \right)=1,4~mol$
=> V = 2 lít = 2000 ml
Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
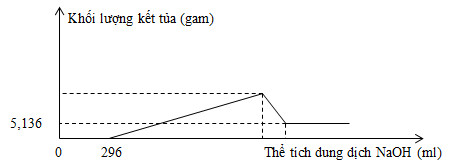
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
Quan sát đồ thị ta thấy:
\({{m}_{Fe{{\left( OH \right)}_{3}}}}=5,136\text{ }gam\Rightarrow {{n}_{Fe{{\left( OH \right)}_{3}}}}=0,048\text{ }mol\)
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: \(3{{n}_{Al~}}=2{{n}_{S{{O}_{2}}}}~=>{{n}_{Al}}~=2.\frac{0,09}{3}=0,06\text{ }mol\)
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,024 ← 0,144 ← 0,048
Cr2O3 + 6HNO3 → 2Cr(NO3)3 + 3H2O
0,02 ← 0,12
\({{m}_{C{{r}_{2}}{{O}_{3}}}}\)(1 phần) = 0,02.152 = 3,04 gam
=> \({{\mathbf{m}}_{\mathbf{C}{{\mathbf{r}}_{\mathbf{2}}}{{\mathbf{O}}_{\mathbf{3}}}}}~=\mathbf{6},\mathbf{08}\text{ }\mathbf{gam}\)
Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 a mol/l (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam(giả thiết toàn bộ lượng kim loại tạo thành đều bám hết vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). giá trị của a là
Dung dịch Y thu được tác dụng với thanh Fe làm cho thanh Fe tăng khối lượng nên Y có Cu2+ dư
Xét phản ứng điện phân dung dịch X
Tại K (-): Cu+2 + 2e → Cu
Tại A (+) : 2Cl - → Cl2 + 2e
nNaCl = 0,6.0,5=0,3 mol
Giả sử Cl- điện phân hết thì nCu = =0,15 mol
→ mdd giảm = mCu + mCl2 = 0,15.64 + 0,3.35,5 = 20,25 < 24,25 => vô lí
→ tại A xảy ra thêm phản ứng sau: 2H2O → O2 + 4H+ + 4e
y → 4y → 4y (mol)
→ nCu phản ứng =
→ mdung dịch giảm = mCu + mCl2 + mO2
=> 64. (0,15+2y) + 0,15.71 + 32y = 24,25
=> y = 0,025 (mol)
Dung dịch Y chứa: H+: 0,1 (mol); Cu2+ dư: z (mol) ; SO42-, Na+
Xét dung dịch Y phản ứng vói Fe
Fe + Cu2+ → Fe2+ + Cu↓
z ← z → z (mol)
Fe + 2H+ → Fe2+ + H2↑
0,05 ←0,1 (mol)
Khối lượng kim loại tăng = mCu - mFe pư
=> 150,04 -150 = 64z - (z + 0,05).56
=> z = 0,4
=> nCu2+ ban đầu = 0,15 + 2y+ z = 0,15 + 2.0,025 + 0,4 = 0,6 (mol)
→ a = 0,6 : 0,6 = 1M
Cho 9,2 gam hỗn hợp X gồm Mg và Fe cho vào dung dịch AgNO3 và Cu(NO3)2 được chất rắn Y gồm 3 kim loại và dung dịch . Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng thu được 6,384 lít SO2 (đktc) – sản phầm khử duy nhất. Cho NaOH dư vào Z thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 8,4 gam hỗn hợp rắn khan. Các phản ứng xảy ra hoàn toàn . % khối lượng Fe ban đầu là
\(Mg,Fe + (A{g^ + },C{u^{2 + }}) \to \left\langle \begin{gathered}Y:Ag,Cu,Fe\xrightarrow{{ + {H_2}S{O_4}dac,{t^0}}}\underbrace {S{O_2}}_{0,285\,mol} + (F{e^{3 + }},C{u^{2 + }},A{g^ + }) \\Z:M{g^{2 + }},Z{n^{2 + }}\xrightarrow{{ + NaOH}}\underbrace{Mg{{(OH)}_2},Fe{{(OH)}_2}}_T\xrightarrow{{{t^0}}}\underbrace {MgO,F{e_2}{O_3}}_{8,4\,(g)} \\\end{gathered} \right.\)
Gọi số mol Mg là x; Fe trong Y là y và Fe trong Z là z
→ mX = 24x + 56y + 56z = 9,2 (1)
Bảo toàn e : 2x + 3y + 2z = 2nSO2= 2.0,285 = 0,57 (2)
mchất rắn = 40x + 80z = 8,4 (3)
giải hệ (1), (2) và (3) ⇒ x = 0,15 ; y = 0,07 ; z = 0,03
→ %Fe = (0,1.56.100)/9,2 = 60,87%
Cho 11,04 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch chứa AgNO3 a mol/lít và Cu(NO3)2 2a mol/lít, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hoàn toàn Y bằng dung dịch H2SO4 đặc nóng dư thu được 7,56 lít khí SO2 (đktc) (sản phẩm khử duy nhất). Cho Z tác dụng với NaOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 10,8 gam hỗn hợp rắn E. Giá trị của a là:
Ta có: nAgNO3 = 0,15a mol; nCu(NO3)2 = 0,15.2a = 0,3a mol; nSO2 = 0,3375 mol
Chất rắn sau khi nung nặng 10,8 gam nên toàn bộ lượng Mg và Fe không chuyển hết về oxit trong E được (Lúc đó khối lượng chất rắn E phải lớn hơn 11,04 gam).
Vậy trong Y phải có Fe dư. → AgNO3 và Cu(NO3)2 đã phản ứng hết.
Đặt số mol Mg, Fe phản ứng và Fe dư lần lượt là x, y, z mol
Ta có: mhỗn hợp X = 24x + 56y + 56z = 11,04 gam (1)
Khi cho Y tác dụng với H2SO4 đặc nóng dư theo bảo toàn electron ta có:
2x + 2y + 3z = 2.0,3375 (*) ↔2x + 2y + 3z = 0,675 (2)
Hỗn hợp rắn E gồm x mol MgO và y/2 mol Fe2O3 → 40x + 160.y/2 = 10,8 gam (3)
Giải hệ 3 phương trình trên ta có: x = 0,18; y = 0,045 và z = 0,075
Thay z vào (*) ta có: a = 0,6
Cho 4,58 gam hỗn hợp A gồm Zn, Fe và Cu vào cốc đựng 85 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và kết tủa C. Nung C trong không khí đến khối lượng không đổi được 6 gam chất rắn D. Thêm dung dịch NaOH dư vào dung dịch B, lọc kết tủa thu được, rửa sạch rồi nung ở nhiệt độ cao đến khối lượng không đổi thu được 5,2 gam chất rắn E. Các phản ứng xảy ra hoàn toàn. % khối lượng mỗi kim loại trong hỗn hợp A (theo thứ tự Zn, Fe, Cu) là:
nKL < 4,58:56 =0,081 <nCuSO4
=> Sau phản ứng CuSO4 còn dư
Gọi nFe, nZn, nCu trong hỗn hợp kim loại lần lượt là a, b,c
=> 56a + 65b + 64c = 4,58 (1)
Kết tủa C gồm có: Cu có trong kim loại (c mol) và Cu sinh ra (a+b) mol
Sau khi nung (a+b+c) mol Cu => (a+b+c) mol CuO
=> a+b+c = 6:80 = 0,075 (2)
Dung dịch B gồm: FeSO4 (a mol); ZnSO4 (b mol); CuSO4 (0,085 -a-b) mol
=> Khi tác dụng NaOH thì kết tủa thu được là Fe(OH)2 (a mol); Cu(OH)2 (0,085 -a-b) mol
Sau khi nung, chất rắn gồm: Fe2O3 (a/2 mol); CuO (0,085 -a -b) mol
=> 80a + (0,085 -a -b)*80 = 5,2 (3)
Từ (1); (2); (3) => a=0,03; b=0,02; c=0,025
=> % Fe = 0,03 * 56/ 4,58 = 36,68%
%Zn = 0,02 * 65/4,58 = 28,38 %
%Cu = 34,94%

