Tính khối lượng kết tủa Al(OH)3 thu được khi cho 100 ml dung dịch AlCl3 1 M tác dụng với 300 ml dung dịch NaOH 1,2 M?
Ta có: nOH- = nNaOH = 0,3.1,2 = 0,36 (mol); nAl3+ = nAlCl3 = 0,1.1 = 0,1 mol
Tính tỉ lệ: k = nOH-/nAl3+ = 0,36 : 0,1 = 3,6
Ta thấy 3 < k < 4 nên kết tủa tan 1 phần → n↓ = 4.nAl3+ - nOH- = 4.0,1 - 0,36 = 0,04 (mol)
→ mAl(OH)3 = 0,04.78 = 3,12 (g)
Cho 31,2 gam hỗn hợp Al, Al2O3 tác dụng với dung dịch NaOH dư thu được 13,44 lít khí (đktc). Tính phần trăm về khối lượng của Al2O3 trong hỗn hợp ban đầu?
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
Theo PTHH (1) ta có: nAl = 2/3 . nH2 = 2/3 . 0,6 = 0,4 (mol)
→ mAl2O3 = 31,2 - mAl = 31,2 - 0,4.27 = 20,4 (g)
Phần trăm về khối lượng của Al2O3 trong hỗn hợp ban đầu là:
%mAl2O3 = \(\frac{{20,4}}{{31,2}}.100\% \) = 65,38%
Cho 31,2 gam hỗn hợp gồm bột Al và Al2O3 tác dụng với dung dịch NaOH dư, thu được 16,8 lít khí hiđro (00C và 0,8 atm). Khối lượng Al trong hỗn hợp ban đầu là
Ta có: \({n_{{H_2}}} = \frac{{PV}}{{RT}} = \frac{{0,8.16,8}}{{0,082.273}} = 0,6\left( {mol} \right)\)
Các PTHH:
Al + NaOH + H2O → NaAlO2 + 3/2 H2 (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
Theo PTHH (1) ta có: nAl = 2/3.nH2 = 2/3.0,6 = 0,4 mol → mAl = 0,4.27 = 10,8 gam.
Cho 300 ml dung dịch chưa đồng thời Ba(OH)2 1M và NaOH 1,5M vào 150 ml dung dịch chứa đồng thời AlCl3 1M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. giá trị của m là
nBa(OH)2 = 0,3.1 = 0,3 (mol) ; nNaOH = 0,3.1,5 = 0,45 (mol)
=> ∑nOH- = 2nBa(OH)2 + nNaOH = 0,3.2 + 0,45 = 1,05 (mol)
nBa2+ = 0,3 (mol)
nAlCl3= 0,15.1 = 0,15 (mol); nAl2(SO4)3 = 0,15.0,5 = 0,075 (mol)
=> ∑nAl3+ = nAlCl3 + 2nAl2(SO4)3 = 0,15 + 0,075.2 = 0,3 (mol) ; nso42- = 0,225 (mol)
Ta có: \(3 < \frac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \frac{{1,05}}{{0,3}} = 3,5 < 4\)=> tạo kết tủa Al(OH)3 và AlO2-
nAl(OH)3 = 4nAl3+ - nOH- = 4.0,3 - 1,05 = 0,15 (mol)
Vây sau phản ứng thu được kết tủa Al(OH)3: 0,15 mol và BaSO4 :0,225 (mol)
=> m↓ = 0,15.78 + 0,225.233 = 64,125 (g)
Cho 3,66 gam hỗn hợp gồm Na và Ba tác dụng với nước dư thu được dung dịch X và 0,896 lít H2 (đktc). Cho 100ml dung dịch Al2(SO4)3 0,1M vào dung dịch X, thu được m gam kết tủa. Giá trị của m là:
Đặt nNa = x và nBa = y (mol)
Na + H2O → NaOH + 0,5 H2
Ba + 2H2O → Ba(OH)2 + H2
Ta có hệ pt: \(\left\{ \begin{array}{l}{m_{hh}} = 23{\rm{x}} + 137y = 3,66\\{n_{{H_2}}} = 0,5{\rm{x}} + y = 0,04\end{array} \right. \to \left\{ \begin{array}{l}x = 0,04\\y = 0,02\end{array} \right.\)
⟹ Dung dịch X chứa: Na+; Ba2+ (0,02 mol) và OH- (0,08 mol)
\(\underbrace {A{l_2}{{(S{O_4})}_3}}_{0,01mol}\left\{ \begin{array}{l}A{l^{3 + }}:0,02\\S{O_4}^{2 - }:0,03\end{array} \right. + X\left\{ \begin{array}{l}N{a^ + }:0,04\\B{a^{2 + }}:0,02\\O{H^ - }:0,08\end{array} \right. \to Ket\,tua\)
PT ion:
Ba2+ + SO42- → BaSO4 ↓
0,02 → 0,02 → 0,02 (mol)
Al3+ + 3OH- → Al(OH)3 ↓
0,02 → 0,06dư 0,02 → 0,02 (mol)
Al(OH)3 + OH- → AlO2- + 2H2O
0,02 0,02
Vậy kết tủa chỉ có 0,02 mol BaSO4
⟹ mkết tủa = 4,66 gam.
Cho 26,03 gam Ba vào 100 ml dung dịch chứa Al2(SO4)3 0,5M đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Phát biểu nào sau đây đúng?
nBa = 26,03 : 137 = 0,19 (mol) ; nAl2(SO4)3 = 0,1.0,5 = 0,05 (mol) => nAl3+ = 0,1 (mol) ; nSO42- = 0,15 (mol)
Ba + 2H2O → Ba(OH)2 + H2↑
0,19 → 0,19 → 0,19 (mol)
=> nBa2+ = 0,19 (mol) và nOH- = 2nBa(OH)2 = 0,38 (mol)
Ba2+ + SO42- → BaSO4↓
0,15← 0,15 → 0,15 (mol)
Ta thấy: \(3 < \frac{{{n_{OH}}^ - }}{{{n_{A{l^{3 + }}}}}} = \frac{{0,38}}{{0,1}} = 3,8 < 4\) => xảy ra phản ứng tạo Al(OH)3 và AlO2-
Al3+ + 3OH- → Al(OH)3↓
Al3+ + 4OH- → AlO2- + 2H2O
áp dụng công thức nhanh ta có: nOH- = 4nAl3+ - nAl(OH)3
=> nAl(OH)3 = 4.0,1 - 0,38 = 0,02 (mol)
Kết tủa gồm: BaSO4: 0,15 (mol) và Al(OH)3: 0,02 (mol) => m kết tủa = 0,15.233 + 0,02.78 = 36,51 (g)
∆ = mBa - mH2 - mkết tủa = 26,03 - 0,19.2 - 36,51 = -10,86 (g)
=> Khối lượng dung dịch sau phản ứng giảm 10,86 (g)
- Sai vì m kết tủa = 36,51 (g)
- đúng
- Sai
- Sai vì m kết tủa = 36,51 (g)
Cho m gam Na và Al vào nước thu được 4,48 lít khí H2 đktc. Mặt khác cho m gam hỗn hợp trên vào dung dịch NaOH dư thu được 11,2 lít H2 đktc.Giá trị của m là
2Na + 2H2O → 2NaOH + H2
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2
Đặt nNa = x và nAl = y
nH2(TH1) = 0,2 mol và nH2(TH2) = 0,5 mol
Vì nH2(TH1) < nH2(TH2) nên trường hợp 1 cho hỗn hợp vào nước thì Al chưa phản ứng hết
→ nH2(TH1) = \(\dfrac{x}{2} + \dfrac{{3x}}{2} = 2x = 0,2\) → x = 0,1 mol
Khi cho hỗn hợp vào dung dịch NaOH dư nên \({n_{{H_2}}} = \dfrac{x}{2} + \dfrac{{3y}}{2} = 0,5 \to y = 0,3\) mol
→ m = 23x + 27y = 23.0,1 + 27.0,3 = 10,4 g
Phèn chua được sử dụng trong công nghiệp nhuộm vải vì sinh ra tác nhân X bị vải hấp thụ giữ chặt trên bề mặt sẽ kết hợp với phẩm nhuộm tạo nên màu bền. X là chất hay ion nào sau đây?
Phèn chua được sử dụng trong công nghiệp nhuộm vải vì sinh ra tác nhân Al(OH)3 do Al3+ thủy phân sinh ra được sợi vải hấp thụ và giữ chặt trên bề mặt sẽ kết hợp với phẩm nhuộm tạo thành màu bền.
PTHH: Al3+ + 3H2O → Al(OH)3↓ + 3H+.
Ở miền Trung thường xuyên bị mưa bão khiến nguồn nước sinh hoạt của người dân sẽ bị đục và ảnh hưởng đến chất lượng. Người dân thường dùng phèn chua làm trong nước sinh hoạt để sử dụng. Phương trình hóa học giải thích cho việc làm đó là
Người dân sử dụng phèn chua để làm trong nước vì khi tan trong nước, phèn chua bị thủy phân và tạo thành Al(OH)3 ở dạng kết tủa keo lơ lửng trong nước. Những hạt kết tủa keo này sẽ kết dính với các hạt bụi bẩn, hạt đất nhỏ để trở thành hạt đất to hơn, nặng hơn và lắng xuống. Vì vậy mà nước trở nên trong hơn.
PTHH: Al3+ + 3H2O → Al(OH)3↓ + 3H+.
Hòa tan hoàn toàn 94,8 gam phèn chua KAl(SO4)2.12H2O vào nước thu được dung dịch X. Cho toàn bộ X tác dụng với 350ml dung dịch chứa Ba(OH)2 0,5M và NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
Bước 1: Tính số mol Al3+, SO42-
Ta có: nKAl(SO4)2.12H2O = 94,8/474 = 0,2 (mol)
⟹ nAl3+ = nKAl(SO4)2.12H2O = 0,2 (mol)
⟹ nSO42- = 2.nKAl(SO4)2.12H2O = 0,4 (mol)
Bước 2: Tính số mol Ba2+ và số mol OH-
Ta có: nBa(OH)2 = 0,35.0,5 = 0,175 mol; nNaOH = 0,35.1 = 0,35 mol
⟹ nBa2+ = nBa(OH)2 = 0,175 (mol)
⟹ nOH- = 2.nBa(OH)2 + nNaOH = 0,7 (mol).
Bước 3: Xác định kết tủa thu được
Al3+ + 3OH- ⟶ Al(OH)3↓
Al(OH)3 + OH- ⟶ AlO2- + 2H2O
Nhận thấy 3.nAl3+ < nOH- < 4.nAl3+
⟹ Kết tủa Al(OH)3 bị hòa tan một phần.
⟹ nAl(OH)3 = 4.nAl3+ - nOH- = 4. 0,2 - 0,7 = 0,1 (mol)
Ba2+ + SO42- → BaSO4↓
0,175 → 0,175 (mol)
Bước 4: Tính m
Kết tủa thu được gồm 0,175 mol BaSO4 và 0,1 mol Al(OH)3.
⟹ m = mBaSO4 + mAl(OH)3 = 48,575 (gam).
Hòa tan hoàn toàn hỗn hợp gồm 0,25 mol Al2O3 và 0,4 mol BaO vào nước dư thu được dung dịch E. Nhỏ từ từ dung dịch HCl k (M) vào E, số mol kết tủa (y mol) thu được phụ thuộc vào số mol HCl phản ứng (x mol) được biểu diễn theo sơ đồ sau:
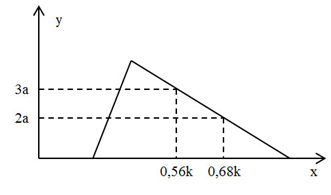
Giá trị của k là:
BaO + H2O → Ba(OH)2
Mol 0,4 → 0,4
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O
Mol 0,25 → 0,25 → 0,25
=> số mol Ba(OH)2 dư = 0,4 – 0,25 = 0,15 mol
Vậy dung dịch E gồm: 0,3 mol OH- ; 0,5 mol AlO22- và Ba2+
Các phản ứng có thể xảy ra:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Tại nHCl = 0,56k (mol) và 0,68k (mol) đều ở bên phải của đỉnh kết tủa (kết tủa max)
=> Lúc này, có sự hòa tan kết tủa bởi HCl nên ta sử dụng công thức:
nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => nAl(OH)3 = 1/3.[4nAlO2 - (nH+ - nOH)]
+ Tại nHCl = 0,56k (mol) => nAl(OH)3 = 3a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)]
=> 3a.3 = 4.0,5 – (0,56k – 0,3) (1)
+ Tại nHCl = 0,68k (mol) => nAl(OH)3 = 2a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)]
=> 2a.3 = 4.0,5 – (0,68k – 0,3) (2)
Giải hệ (1) và (2) => k = 2,5 (M)
Cho 200 ml dung dịch NaOH vào dung dịch chứa 0,019 mol Al(NO3)3 thu được 0,936 gam kết tủa. Nồng độ mol lớn nhất của dung dịch NaOH cần phải dùng là:
Vì nAl(OH)3 = 0,936: 78 = 0,012 mol < nAl3+ = 0,019 mol
Lượng NaOH lớn nhất cần dùng khi có sự hòa tan kết tủa
nOH- = 4nAl3+ - nAl(OH)3 = 4.0,019 - 0,012 = 0,064 mol
=> CM = 0,064 : 0,2 = 0,32 M
Cho 7,8 gam hỗn hợp X gồm Al và Al2O3 tác dụng với 700 ml dung dịch HCl 1M, thu được dung dịch Y và 3,36 lít khí H2. Cho Y tác dụng với V lít dung dịch NaOH 1M, thu được 11,7 gam kết tủa. Giá trị lớn nhất của V là :
2Al + 6HCl → 2AlCl3 + 3H2
0,1 0,15 mol
Al2O3 + 6HCl → 2AlCl3 + 3H2O
→ mAl2O3 = 7,8 – 0,1.27 = 5,1 g → nAl2O3 = 0,05 mol
→ nHCl phản ứng = 0,05.6 + 0,1.3 = 0,6 < nHCl = 0,7 mol
Nên sau phản ứng dung dịch thu được có 0,2 mol AlCl3 và 0,1 mol HCl
Y + NaOH → kết tủa Al(OH)3 : 0,15 mol < nAlCl3 = 0,2 mol
→ nên để kết tủa thu được là lớn nhất thì kết tủa Al(OH)3 tạo tối đa rồi tan một phần
NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
nNaOH = nHCl + 3nAlCl3 + nAl(OH)3 hòa tan = 0,1 + 3.0,2 + (0,2 – 0,15) = 0,75 mol → V = 0,75 : 1 = 0,75 lít
Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,2 mol AlCl3 và 0,2 mol HCl đến khi phản ứng xảy ra hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là
nAl(OH)3 = 0,1 mol
PTHH : NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → 3NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 +2 H2O
Để lượng NaOH phản ứng là lớn nhất thì kết tủa tạo thành tối đa rồi tan một phần
Ta có \({n_{NaOH}} = {n_{HCl}} + 3{n_{AlC{l_3}}} + {n_{Al{{(OH)}_3}\,hoa\,\tan }} = 0,2 + 3.0,2 + (0,2 - 0,1) = 0,9\,mol\)
=> V = 0,9 : 2 =0,45 lít
Cho từ từ V ml dung dịch NaOH 1M vào 200 ml dung dịch gồm HCl 0,5M và Al2(SO4)3 0,25M. Đồ thị biểu diễn khối lượng kết tủa theo V như hình dưới đây
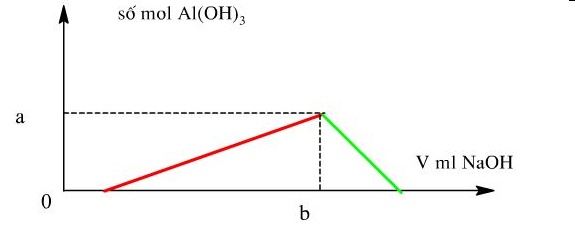
Giá trị của a, b tương ứng là
nAl2(SO4)3 = 0,05 mol và nHCl= 0,1 mol
Ta có PTHH : NaOH + HCl → NaCl + H2O
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Theo đồ thị kết tủa lớn nhất khi nAl(OH)3 = 2nAl2(SO4)3 = 2.0,05 = 0,1 mol → a = 0,1 mol
Tại thời điểm kết tủa thu được lớn nhất thì nNaOH = 6nAl2(SO4)3 + nHCl = 6.0,05 + 0,1 = 0,4 mol
→ b = 0,4 : 1 = 0,4 lít = 400 ml
Hòa tan 8,6 gam hỗn hợp kim loại K và Al vào nước, sau phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí (đktc) và m gam chất không tan. Giá trị của m là
Chất rắn không tan là Al còn dư
Gọi nK = x mol => nAl phản ứng = x
K → K+ + 1e 2H+ + 2e → H2
x x 4x → 2x
Al → Al3+ + 3e
x 3x
=> 2x = 0,2 => x = 0,1 mol => mAl dư = 8,6 - 39.0,1 - 27.0,1 = 2 gam
Tính khối lượng kết tủa Al(OH)3 thu được khi cho 100 ml dung dịch AlCl3 1 M tác dụng với 300 ml dung dịch NaOH 1,2 M?
Ta có: nOH- = nNaOH = 0,3.1,2 = 0,36 (mol); nAl3+ = nAlCl3 = 0,1.1 = 0,1 mol
Tính tỉ lệ: k = nOH-/nAl3+ = 0,36 : 0,1 = 3,6
Ta thấy 3 < k < 4 nên kết tủa tan 1 phần → n↓ = 4.nAl3+ - nOH- = 4.0,1 - 0,36 = 0,04 (mol)
→ mAl(OH)3 = 0,04.78 = 3,12 (g)
Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là
Ta có: nAl3+ = 0,2.1,5 = 0,3 mol; nAl(OH)3 = 15,6 : 78 = 0,2 mol
Thứ tự phản ứng khi cho từ từ OH- vào Al3+:
(1) Al3+ + 3OH- → Al(OH)3
(2) Al(OH)3 + OH- → AlO2- + 2H2O
Lượng V lớn nhất khi có sự hòa tan một phần kết tủa.
Áp dụng công thức tính nhanh:
∑nOH- = 4nAl3+ - nAl(OH)3 = 4.0,3 - 0,2 = 1 mol → V = nNaOH : CM = 1 : 0,5 = 2,0 (lít)
Cho 4,005 g AlCl3 vào 1000 ml dung dịch NaOH 0,1M. Sau khi phản ứng xong thu được khối lượng kết tủa là
\({n_{AlC{l_3}}} = 0,03mol;{n_{NaOH}} = 0,1mol\)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
0,03 → 0,09 → 0,03 (mol)
Al(OH)3 + NaOH → NaAlO2 + 2H2O
0,01 ← 0,1 - 0,09 = 0,01 (mol)
⟹ nAl(OH)3 còn lại = 0,03 - 0,01 = 0,02 (mol)
⟹ mAl(OH)3 còn lại = 78.0,02 = 1,56 (g)
Cho từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp x mol HNO3 và y mol Al(NO3)3, kết quả thí nghiệm được biểu diễn trên đồ thị sau
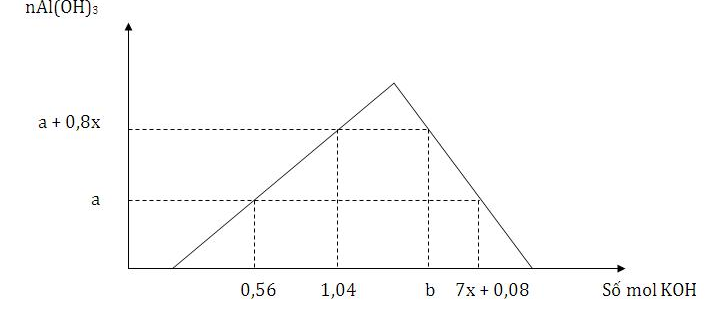
Tỉ lệ của b : a có giá trị là
KOH + HNO3 → KNO3 + H2O
3KOH + Al(NO3)3 → 3KNO3 + Al(OH)3
KOH + Al(OH)3 → KAlO2 + 2H2O
Xét tại các thời điểm
+) có 0,56 mol KOH thì chỉ xảy ra 2 phản ứng đầu → nKOH = nHNO3 + 3nAl(OH)3 = x + 3a = 0,56 mol
+) có 1,04 mol KOH thì chỉ có 2 phản ứng đầu xảy ra → nKOH = nHNO3 + 3nAl(OH)3 = x + 3(a + 0,8x ) =1,04
→ x = 0,2 mol và a = 0,12 mol
+) tại thời điểm b mol KOH thì xảy ra cả 3 phản ứng và thu được nAl(OH)3 = a + 0,8x = 0,28 mol
→ nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan = x + 3y + (y – 0,28) =0,2 + 4y – 0,28 = 4y – 0,08 (mol) = b(1)
+) tại thời điểm (7x + 0,08) mol KOH hay 1,48 mol KOH thì nAl(OH)3 = 0,12 mol và cả 3 phản ứng xảy ra
→ nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan = x + 3y + (y – 0,12) = 4y + 0,08 = 1,48 → y = 0,35 (2)
Từ (1) và (2) suy ra b = 1,32 mol
→ b : a = 1,32 : 0,12 = 11

