Hòa tan m gam Al bằng dung dịch NaOH dư. Sau khi phản ứng kết thúc thu được 3,36 lít khí H2(đktc). Giá trị của m là
nH2(đktc) = 3,36 : 22,4 = 0,15 (mol)
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
0,1 ← 0,15 (mol)
=> mAl = 0,1.27 = 2,7 (lít)
Cho 200 ml dung dịch Al2(SO4)3 0,5M tác dụng với 200 gam dd NaOH thu được 11,7 gam kết tủa trắng. Nồng độ dung dịch NaOH lớn nhất là
nAl2(SO4)3 = 0,1 mol → nAl3+ = 0,2 mol
nAl(OH)3 = 0,15 mol
Vì nAl(OH)3 < nAl(3+) nên có 2 trường hợp là kết tủa tạo tối đa rồi tan hoặc kết tủa chưa tối đa
→để NaOH là lớn nhất thì kết tủa tối đa rồi tan 1 phần
Al3+ + 3OH- → Al(OH)3
0,2 → 0,6 → 0,2 mol
Al(OH)3 + OH- → AlO2- + 2H2O
(0,2 - 0,15) → 0,05 mol
→ nOH- (tổng ) = 0,6 + 0,05 = 0,65 mol
Bảo toàn OH- có nNaOH = nOH- = 0,65 mol => mNaOH = 0,65.40 = 26 (g)
\(C\% NaOH = \dfrac{{{m_{NaOH}}}}{{m{\,_{dd\,NaOH}}}}.100\% = \dfrac{{26}}{{200}}.100\% = 13\% \)
Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch AlCl3 1M, sau khi phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa. Giá trị lớn nhất của V là
3NaOH + AlCl3 → 3NaCl + Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
nAlCl3 = 0,2 mol và nAl(OH)3 = 0,05 mol
Vì nAl(OH)3 < nAlCl3 nên xảy ra 2 trường hợp : kết tủa chưa tạo thành tối đa hoặc kết tủa tối đa rồi tan một phần
Để NaOH lớn nhất thì kết tủa tạo thành tối đa rồi tan một phần
=> nNaOH = 3nAlCl3 + nAl(OH)3 bị hòa tan = 3.0,2 + (0,2 – 0,05 ) = 0,75 mol
=> V = 0,75 : 2 =0,375 lít = 375 ml
Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch hỗn hợp Al2(SO4)3 và Na2SO4 ta có đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo số mol Ba(OH)2 như sau
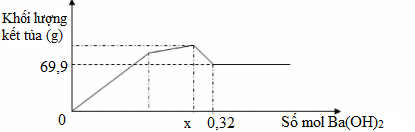
Dựa vào đồ thị hãy xác định giá trị của x
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3
Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
OH- + Al(OH)3 → AlO2- + H2O
Từ đồ thị ta thấy, đoạn đầu khối lượng kết tủa tăng nhanh khi tạo cả 2 kết tủa BaSO4 và Al(OH)3
→ đoạn sau Al3+ hết chỉ còn SO42- → m kết tủa cực đại khi kết tủa hoàn toàn gốc SO42-
Tại thời điển Ba(OH)2 : 0,32 mol thì mkết tủa = mBaSO4 → nBaSO4 = 0,3 mol → nSO4 = 0,3 mol
mol ( do phản ứng tạo kết tủa tối đa rồi tan hoàn toàn )
Vì m cực đại khi kết tủa hoàn toàn SO42- nên nBa(OH)2 = nSO4 = 0,3
Cho V ml dung dịch KOH 2M vào 150 ml dung dịch Al2(SO4)3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được 19,5 gam kết tủa. Giá trị lớn nhất của V là
nAl2(SO4)3 = 0,15 mol
nAl(OH)3 = 0,25 mol
→ vì nAl(OH)3 < nAl3+ nên để KOH có thể tích lớn nhất thì kết tủa tạo thành tối đa rồi tan một phần
PTHH : Al3+ + 3 OH- → Al(OH)3
0,3 → 0,9 mol
Al(OH)3 + OH- → AlO2- + H2O
(0,3 – 0,25)→ 0,05 mol
→ nOH- = 0,9 + 0,05 = 0,95 mol→ V = 0,95 : 2 = 0,475 lít = 475 ml
Phản ứng của dung dịch Al2(SO4)3 với lượng dư chất nào sau đây thu được kết tủa sau khi phản ứng kết thúc?
A loại vì NaCl không phản ứng với Al2(SO4)3
B thỏa mãn vì 6NH3 dư + Al2(SO4)3 + 3H2O → 3(NH4)2SO4 + 2Al(OH)3 ↓ (kết tủa Al(OH)3 không tan trong NH3)
C loại vì 6NaOH + Al2(SO4)3→ 2Al(OH)3 + 3Na2SO4; Al(OH)3 + NaOH → NaAlO2 + 2H2O
D loại vì H2SO4 không phản ứng với Al2(SO4)3
Hòa tan hoàn toàn 4,05 gam Al bằng dung dịch NaOH dư thu được V lít H2( đo ở đktc). Giá trị của V là:
nAl = mAl : MAl = 4,05 : 27 = 0,15 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Theo PTHH: nH2 = 3/2 nAl = 3/2 ×0,15 = 0,225 (mol)
⟹ VH2(đktc) = nH2×22,4 = 0,225×22,4 = 5,04 (lít)
Cho từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp x mol HNO3 và y mol Al(NO3)3, kết quả thí nghiệm được biểu diễn trên đồ thị sau
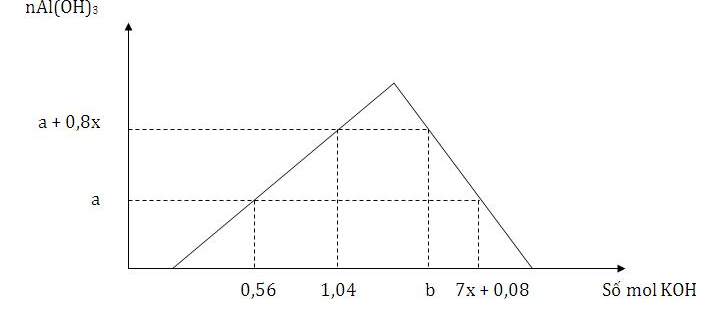
Tỉ lệ của b : a có giá trị là
KOH + HNO3 → KNO3 + H2O
3KOH + Al(NO3)3 → 3KNO3 + Al(OH)3
KOH + Al(OH)3 → KAlO2 + 2H2O
Xét tại các thời điểm
+) có 0,56 mol KOH thì chỉ xảy ra 2 phản ứng đầu
→ nKOH = nHNO3 + 3nAl(OH)3 = x + 3a = 0,56 mol
+) có 1,04 mol KOH thì chỉ có 2 phản ứng đầu xảy ra
→ nKOH = nHNO3 + 3nAl(OH)3 = x + 3(a + 0,8x ) =1,04
→ x = 0,2 mol và a = 0,12 mol
+) tại thời điểm b mol KOH thì xảy ra cả 3 phản ứng và thu được
nAl(OH)3 = a + 0,8x = 0,28 mol
→ nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan = x + 3y + (y – 0,28) =0,2 + 4y – 0,28 = 4y – 0,08 (mol) = b(1)
+) tại thời điểm (7x + 0,08) mol KOH hay 1,48 mol KOH thì nAl(OH)3 = 0,12 mol và cả 3 phản ứng xảy ra
→ nKOH = nHNO3 + 3nAl(NO3)3 + nAl(OH)3 bị hòa tan
= x + 3y + (y – 0,12) = 4y + 0,08 = 1,48 → y = 0,35 (2)
Từ (1) và (2) suy ra b = 1,32 mol
→ b : a = 1,32 : 0,12 = 11
Cho 1,44 gam bột Al vào dung dịch NaOH dư, kết thúc thí nghiệm thu được V lít khí H2 (đktc). Giá trị của V là
\({n_{Al}} = \frac{{1,44}}{{27}} = \frac{4}{{75}}\left( {mol} \right)\)
Cách 1: Tính theo PTHH
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
4/75 → 0,08 (mol)
⟹ V = 0,08.22,4 = 1,792 lít
Cách 2:
Áp dụng bảo toàn e: 3nAl = 2nH2 → \({n_{{H_2}}} = \frac{{3{n_{Al}}}}{2} = \frac{{3.\left( {4/75} \right)}}{2} = 0,08\left( {mol} \right)\)
⟹ V = 0,08.22,4 = 1,792 lít
Hòa tan vừa hết 7 gam hỗn hợp X gồm Al và Al2O3 trong dung dịch NaOH đun nóng, thì có 0,2 mol NaOH đã phản ứng, sau phản ứng thu được V lít khí H2 (đktc). Giá trị của V là
Đặt 7 gam hh X \(\left\{ \begin{array}{l}Al:\,a(mol)\\A{l_2}{O_3}:\,b\,(mol)\end{array} \right.\)
PTHH: Al + NaOH + H2O → NaAlO2 + 3/2H2↑
(mol) a → a → 1,5a
Al2O3 + 2NaOH → 2NaAlO2 + H2O
(mol) b → 2b
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_X} = 27a + 102b = 7\\{n_{NaOH}} = a + 2b = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = \frac{2}{{15}}\\b = \frac{1}{{30}}\end{array} \right.\)
Theo PTHH (1): nH2 = 1,5a = 1,5.2/15 = 0,2 (mol)
⟹ VH2(đktc) = 0,2.22,4 = 4,48 (lít)
Thực hiện thí nghiệm nhỏ từ từ dung dịch Y tới dư vào dung dịch X mà cuối cùng thu được kết tủa. Vậy X, Y lần lượt là
A. Loại, vì cho từ từ đến dư Al2(SO4)3 vào dd KOH tạo kết tủa Al(OH)3, kết tủa tan hết trong KOH
PTHH: Al2(SO4)3 + 8KOH → 2KAlO2 + 3K2SO4 + 4H2O
B. Loại, vì không thu được kết tủa
AlCl3 + 4NaOH → NaAlO2 + 2H2O
C. Thỏa mãn, thu được kết tủa Al(OH)3
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
D. Loại, vì không thu được kết tủa
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Hòa tan hoàn toàn 5,40 gam Al trong dung dịch NaOH (dư), thu được V lít khí H2 (đktc). Giá trị của V là
nAl = mAl : MAl = 5,4 : 27 = 0,2 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Theo PTHH: nH2 = 3/2 nAl = 3/2. 0,2 = 0,3 (mol)
→ VH2(đktc) = nH2 × 22,4 = 0,3 × 22,4 = 6,72 (lít)
Hòa tan hoàn toàn 7,8 gam hỗn hợp X gồm Al và Al2O3 trong lượng dư dung dịch NaOH, thu được 3,36 lít H2. Số mol của Al2O3 có trong 15,6 gam X trên là
nH2(đktc) = VH2/22,4 = 3,36/22,4 = 0,15 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (1)
(mol) 0,1 ← 0,15
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
Theo PTHH (1): nAl = 2/3 nH2 = 2/3. 0,15 = 0,1 (mol)
→ mAl = nAl×MAl = 0,1×27 = 2,7 (g)
Trong 7,8 (g) có chứa: mAl2O3 = 7,8 – mAl = 7,8 – 2,7 = 5,1 (g)
Vậy trong 15,6 (g) có chứa 5,1×2 = 10,2 (g) Al2O3
→ nAl2O3 = mAl2O3 : MAl2O3 = 10,2 : 102 = 0,1 (mol)
Thể tích (ml) dung dịch KOH 0,5M cần dùng để hòa tan hết 5,1 gam bột nhôm oxit là
nAl2O3 = mAl2O3 : MAl2O3 = 5,1 : 102 = 0,05 (mol)
PTHH: 2KOH + Al2O3 → 2KAlO2 + H2O
(mol) 0,1 ← 0,05
Theo PTHH: nKOH = 2nAl2O3 = 2.0,05 = 0,1 (mol)
→ VKOH = nKOH : CM = 0,1 : 0,5 = 0,2 (lít) = 200 (ml)
Hòa tan hoàn toàn 0,2 mol Al bằng dung dịch KOH dư, thu được V lít H2 (đktc). Giá trị của V là
PTHH: 2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑
(mol) 0,2 → 0,3
Theo PTHH: nH2 = 3/2 nAl = 3/2 . 0,2 = 0,3 (mol)
→ VH2(đktc) = nH2×22,4 = 0,3×22,4 = 6,72 (lít)
Để hòa tan hoàn toàn 5,4 gam Al cần dùng vừa đủ V ml dung dịch NaOH 0,5M. Giá trị của V là
nAl = mAl/MAl = 5,4/27 = 0,2 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,2 → 0,2
Theo PTHH: nMaOH = nAl = 0,2 (mol)
→ VNaOH = nNaOH : CM NaOH = 0,2 : 0,5 = 0,4 (lít) = 400 ml
Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch AlCl3 1M, sau khi phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa. Giá trị lớn nhất của V là
3NaOH + AlCl3 → 3NaCl + Al(OH)3
Al(OH)3 + NaOH → NaAlO2 + 2H2O
\({n_{AlC{l_3}}}\) = 0,2 mol và \({n_{Al{{(OH)}_3}}}\) = 0,05 mol
Vì \({n_{Al{{(OH)}_3}}} < {n_{AlC{l_3}}}\) nên xảy ra 2 trường hợp : kết tủa chưa tạo thành tối đa hoặc kết tủa tối đa rồi tan một phần
Để NaOH lớn nhất thì kết tủa tạo thành tối đa rồi tan một phần
\( \to \) nNaOH = \(3{n_{AlC{l_3}}} + {n_{Al{{(OH)}_3}}}\) bị hòa tan = 3.0,2 + (0,2 – 0,05 ) = 0,75 mol
\( \to \) V = \(\dfrac{{0,75}}{2}\) = 0,375 lít = 375 ml
Để hòa tan hoàn toàn 1,02 gam Al2O3 cần dùng tối thiểu V ml dung dịch NaOH 1M. Giá trị của V là
nAl2O3 = 1,02/102 = 0,01 mol
PTHH: Al2O3 + 2NaOH → 2NaAlO2 + H2O
(mol) 0,01 → 0,02 (mol)
→ Vdd NaOH = n/CM = 0,02/1 = 0,02 (lít) = 20 ml
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Nếu b ≥ 4a thì kết tủa bị hoà tan hoàn toàn => để thu được kết tủa thì b < 4a
Dùng 200 ml dung dịch NaOH 1M để hòa tan hết tối đa m gam Al2O3. Giá trị của m là
2NaOH + Al2O3 → 2NaAlO2 + H2O
0,2 → 0,1
=> mAl2O3 = 0,1.102 = 10,2 gam

