Hỗn hợp X gồm Al, Ba, Al4C3 và BaC2. Cho 29,7 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy hết Z, thu được 4,48 lít CO2 (đktc) và 9,45 gam H2O. Nhỏ từ từ 120ml dung dịch H2SO4 1M vào Y, thu được m gam kết tủa. Giá trị của m là
Trả lời bởi giáo viên
Bước 1: Tính nO khi đốt cháy Z
- nCO2 = 0,2 mol ; nH2O = 0,525 mol
- BTNT O: nO = 2nCO2 + nH2O = 0,925 mol
Bước 2: Tính nBa, nAl
- Quy đổi 15,15 gam hỗn hợp X thành Ba (a mol), Al (b mol), C (0,2 mol)
- Xét quá trình đốt hỗn hợp khí Z, ta có hệ sau:
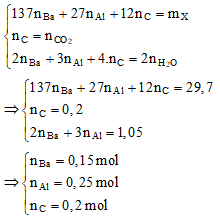
Bước 3: Tính m gam kết tủa
- Dung dịch Y gồm Ba2+ (0,15 mol), AlO2- (0,25 mol) và OH-.
- BTĐT: ${n_{O{H^ - }}} = 2{n_{B{a^{2 + }}}} - {n_{Al{O_2}^ - }} = 0,05\,mol$
- Cho 0,12 mol H2SO4 tác dụng với dung dịch Y: ${n_{Al{O_2}^ - }} > {n_{{H^ + }}} - {n_{O{H^ - }}}$
⇒${{\text{n}}_{{\text{Al(OH}}{{\text{)}}_{\text{3}}}}}{\text{ = }}{{\text{n}}_{{{\text{H}}^{\text{ + }}}}}{\text{ - }}{{\text{n}}_{{\text{O}}{{\text{H}}^{\text{ - }}}}}{\text{ = 0,19}}\;{\text{mol}}$ và BaSO4: 0,12 mol ⇒ mkết tủa = 42,78 (g)
Hướng dẫn giải:
Bước 1: Tính nO khi đốt cháy Z
- Tính nCO2, nH2O
- BTNT O: nO = 2nCO2 + nH2O
Bước 2: Tính nBa, nAl
- Quy đổi hỗn hợp X thành Ba (a mol), Al (b mol), C (0,2 mol)
- Lập hệ phương trình tính a, b: dựa vào mX, BT e
Bước 3: Tính m gam kết tủa
- Dung dịch Y chứa Ba2+, AlO2- ⟹ BTĐT tính nOH-
- Tính nAl(OH)3 ⟹ mAl(OH)3