Ở toC khi cho 2 gam MgSO4 vào 200 gam dung dịch MgSO4 bão hòa đã làm cho m gam tinh thể muối MgSO4.nH2O (A) kết tinh. Nung m gam tinh thể A cho đến khi mất nước hoàn toàn thì thu được 3,16 gam MgSO4. Xác định công thức phân tử của tinh thể muối A. Cho biết độ tan của MgSO4 ở toC là 35,1 gam.
Trả lời bởi giáo viên
- Công thức tinh thể là MgSO4.nH2O.
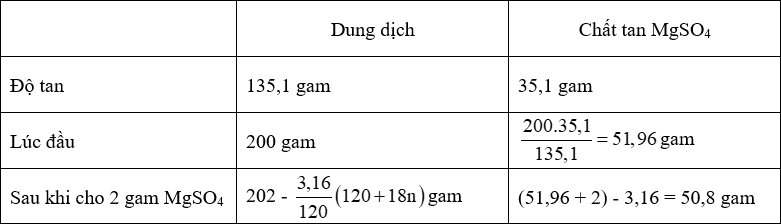
- Ta có:
+ 135,1 gam dd có chứa 35,1 gam MgSO4
+ [202 - \(\dfrac{{3,16}}{{120}}\)(120 + 18n)] gam dd có chứa 50,8 gam MgSO4.
⟹ [202 - \(\dfrac{{3,16}}{{120}}\)(120 + 18n)].35,1 = 135,1.50,8
⟹ n = 7
⟹ Công thức của tinh thể A là MgSO4.7H2O.
Hướng dẫn giải:
Bước 1: Đặt công thức của muối là MgSO4.nH2O.
Bước 2: Lập bảng tính
- Tính mdd MgSO4 lúc đầu, sau khi cho thêm 2 gam MgSO4.
- Tính mchất tan MgSO4 lúc đầu, sau khi cho thêm 2 gam MgSO4 .
Bước 3: Tìm n, xác định CTPT muối tinh thể.
- Lập biêu thức tính n theo tỉ lệ:
+ 135,1 gam dd có chứa 35,1 gam MgSO4
+ [202 - \(\dfrac{{3,16}}{{120}}\)(120 + 18n)] gam dd có chứa 50,8 gam MgSO4.
- Từ n, lập CT của tinh thể muối

