Ở nhiệt độ 20oC, khối lượng riêng của kim loại X bằng 10,48 g/cm3 và bán kính nguyên tử X là 1,446.10-8 cm. Giả thiết trong tinh thể các nguyên tử X có dạng hình cầu và có độ rỗng là 26%. Biết số Avogadro NA = 6,022.1023. Kim loại X là
Thể tích 1 nguyên tử X là: ${{V}_{ngtu}}=\frac{4}{3}\pi {{r}^{3}}$
Thể tích nguyên tử (phần đặc) trong 1cm3 tinh thể là: 1.(100%-26%) = 0,74 cm3
1cm3 tinh thể có số nguyên tử là: $\frac{0,74}{\frac{4}{3}.\pi .{{r}^{3}}}=\frac{0,74}{\frac{4}{3}.\pi .{{(1,{{446.10}^{-8}})}^{3}}}=5,{{843.10}^{22}}$ nguyên tử
Khối lượng 1 nguyên tử: $\frac{10,48}{5,{{843.10}^{22}}}=1,{{79.10}^{-22}}$ (g)
Khối lượng 1 mol nguyên tử: 1,79.10-22.6,022.1023 = 108 g/mol
=> X là Ag
Cho 5,85 gam muối NaX tác dụng với dung dịch AgNO3 dư thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X (x1%) và 37X (x2%). Vậy giá trị của x1% và x2% lần lượt là:
Khi cho NaX vào AgNO3 thu được kết tủa AgX
Ta có: NaX + AgNO3 → AgX ↓ + NaNO3
Ta có: nNaX= nAgX suy ra \({{5,85} \over {23 + {M_X}}} = {{14,35} \over {108 + {M_X}}}\)
→ MX= 35,5
Nguyên tử khối trung bình của X được tính theo công thức sau:
\(35,5 = {{35.{x_1} + 37.{x_2}} \over {100}}\)
Mặt khác x1 + x2= 100
Giải hệ trên ta có x1= 75 và x2= 25
Trong tự nhiên clo có hai đồng vị bền là 35Cl và 37Cl trong đó 35Cl chiếm 75,77% số nguyên tử. Phần trăm khối lượng 37Cl trong HClOn là 13,09%. Giá trị của n là:
Ta có: %35Cl = 100% - 75,77%= 24,23%
Nguyên tử khối trung bình của clo là MCl= 35. 0,7577 + 37. 0,2423= 35,4846
Vậy phần trăm khối lượng của 37Cl trong HClOn là: \({{37.0,2423} \over {1 + 35,4846 + 16n}}.100\% = 13,09\% \)
Giải phương trình trên ta có n = 2
Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%. Tính thành phần % khối lượng của 56Fe trong FeBr3 là?
Nguyên tử khối trung bình của Fe là
\(\overline {{A_{Fe}}} = {{5,8.54 + 91,72.56 + 2,2.57 + 0,28.58} \over {100}} = 55,9116\)
Nguyên tử khối trung bình của Br là:
\(\overline {{A_{Br}}} = {{79.50,69 + 81.49,31} \over {100}} = 79,9862\)
Phần trăm khối lượng của 56Fe trong FeBr3 là %m56Fe= \({{0,9172.56} \over {55,9116 + 3.79,9862}}.100\% = 17,36\% \)
X, Y, Z là 3 nguyên tố hoá học. Tổng số hạt mang điện trong 3 phân tử X2Y, ZY2 và X2Z là 200. Số hạt mang điện của X2Y=15/16 lần số hạt mang điện của ZY2. Ở trạng thái cơ bản nguyên tử Z có số electron s< =8, số electron p=1,667 lần số electron s. R là phân tử hợp chất giữa X,Y,Z gồm 6 nguyên tử. Hãy xác định số hạt mang điện của phân tử R
* Xét Z:
+ Số electron s <= 8
+ Số electron p = 1,667 số electron s
Thay số electron = 1, 2, 3, ..., 8 vào thì thấy có 1 trường hợp duy nhất thỏa mãn là:
Số electron s = 6 và số electron p = 10
Vậy cấu hình e của Z là 1s2 2s2 2p6 3s2 3p4 => ZZ = 16 => Z là lưu huỳnh
* Giả sử X có số e = p = ZX và Y có e = p = ZY
- Tổng số hạt mang điện trong 3 phân tử X2Y, ZY2 và X2Z là 200
=> (4ZX + 2ZY) + (2.16 + 4.ZY) + (4ZX + 2.16) = 200 (1)
- Số hạt mang điện của X2Y=15/16 lần số hạt mang điện của ZY2
=> 4ZX + 2ZY = 15/16.(2.16 + 4.ZY) (2)
Giải hệ (1) và (2) được ZX = 11 (Na) và ZY = 8 (O)
R là hợp chất của Na, O, S mà R có 6 nguyên tử nên R là Na2SO3
=> Số hạt mang điện của Na2SO3 là 4.11 + 2.16 + 6.8 = 124
Hợp chất A được tạo thành từ các ion X3+ và Y2 -(X, Y là kí hiệu các nguyên tố chưa biết). Tổng số hạt proton, nơtron, electron trong một phân tử A bằng 224, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 64 hạt. Số khối của X lớn hơn số khối của Y là 36 đơn vị. Tổng số hạt proton, nơtron, electron trong X3+ nhiều hơn trong Y2- là 47 hạt. Công thức phân tử của A là
Công thức tổng quát của A là: X2Y3. Gọi số hạt proton, nơtron và electron trong A lần lượt là P, N, E
\(\left\{ \begin{array}{l}
{\rm{2P + N = 224}}\\
{\rm{2P - N = 64}}
\end{array} \right. \to \left\{ \begin{array}{l}
{\rm{P = 72}}\\
{\rm{N = 80}}
\end{array} \right.\)
=> 2PX + 3PY = 72 (1)
- Số khối của X lớn hơn số khối của Y là 36 đơn vị:
(PX + NX) - (PY + NY) = 36 → (PX – PY) + (NX – NY) = 36 (2)
- Tổng số hạt proton, nơtron, electron trong X3+ nhiều hơn trong Y2- là 47 hạt:
(2PX + NX -3)-(2PY + NY + 2) = 47 → 2(PX – PY) + (NX – NY) = 52 (3)
- Giải hệ phương trình gồm (2) và (3) ta có:
PX – PY = 16 (4) và NX – NY = 20
- Giải hệ phương trình gồm (1) và (4) ta có:
PX = ZX = 24 (Cr) và PY = ZY = 8 (O) → CT oxit là: Cr2O3
Điện tích hạt nhân của nguyên tử nguyên tố X là +8,4906.10-18 Culong. Tỉ số nơtron và số đơn vị điện tích hạt nhân của X bằng 1,3962. Số nơtron của X bằng 3,7 lần số nơtron của nguyên tử nguyên tố Y. Khi cho 4,29 gam Y tác dụng với lượng dư X thu được 18,26 gam sản phẩm có công thức XY. Số hạt proton có trong hạt nhân nguyên tử Y là?
Vì điện tích hạt nhân của nguyên tử nguyên tố X là +8,4906.10-19 Culong nên số hạt proton có trong hạt nhân nguyên tử X là (+8,4906.10-18) : (+1,602.10-19)= 53
Tỉ số nơtron và số đơn vị điện tích hạt nhân X bằng 1,3962 nên số notron trong X bằng 1,3962.53= 74.
Số khối của A bằng PX + NX= 53 + 74= 127. Vậy X là nguyên tố I.
Vì số nơtron của X bằng 3,7 lần số nơtron của nguyên tử nguyên tố Y nên NY= 74 : 3,7= 20.
X + Y → XY
4,29 18,26
Vậy \({Y \over {4,29}} = {{X + Y} \over {18,26}} \to {Y \over {4,29}} = {{127 + Y} \over {18,26}}\) → Y = 39
Ta có AY= NY + Py → PY= 39 – 20= 19
Số hạt proton có trong hạt nhân nguyên tử Y là 19.
Giả thiết trong mạng tinh thể, các nguyên tử Fe là những hình cầu chiếm 74% về thể tích, phần còn lại là các khe rỗng, cho nguyên tử khối trung bình của Fe là 55,85. Biết ở 20oC, khối lượng riêng của sắt là 7,87 gam/cm3. Bán kính nguyên tử của Fe là:
Xét 1 mol tinh thể Fe chứa 6,022.1023 nguyên tử Fe xếp khít nhau và các khe rỗng.
→ mtt = 55,85 gam
→ Vtt = mtt : Dtt = 55,85 : 7,87 = 7,1 cm3
→ Vphần đặc = 7,1.74% = 5,25 cm3
→ V 1 nguyên tử = 5,25 : 6,022.1023 = 8,72.10-24 (cm3)
Mà nguyên tử có hình cầu nên: V nguyên tử = 4/3.π.r3
→ 8,72.10-24 = 4/3.3,14.r3
→ r = 1,28.10-8 cm
Cho bảng thông tin về ba nguyên tử A, B, C thuộc về hai nguyên tố hoá học X và Y. Trong thực tế, nguyên tố X có hai đồng vị là \({}^mX,\,{}^nX\) (m>n) và có nguyên tử khối trung bình là 63,6.
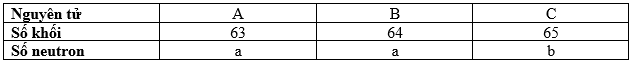
Phát biểu nào sau đây không đúng?
Hai nguyên tử là đồng vị của nhau khi có cùng số proton nhưng khác số neutron => Có số khối khác nhau
=> A và C là đồng vị của nhau và cùng thuộc nguyên tố X
Mà X có hai đồng vị là \({}^mX,\,{}^nX\) (m>n) => A là đồng vị \(^nX\); C là đồng vị \(^mX\)
Gọi phần trăm về số nguyên tử của \(^nX\), \(^mX\) lần lượt là a và b
\( \Rightarrow \left\{ {\begin{array}{*{20}{c}}{a + b = 100}\\{63a + 65b = 63,6.100}\end{array}} \right. \Leftrightarrow \left\{ {\begin{array}{*{20}{c}}{a = 70}\\{b = 30}\end{array}} \right.\)
=> B là đồng vị của nguyên tố Y

