\[\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,C{{H}_{3}}COOH\text{ }+\text{ }{{C}_{2}}{{H}_{5}}OH~~\overset{H2SO4}{\leftrightarrows}\text{ }C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}~\text{ }+\text{ }{{H}_{2}}O~~~~\text{ (}{{K}_{cb}}\text{ }=\text{ }4)\]
\[\begin{array}{l}bd(mol)\,\,\,\,\,\,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1\\pu(mol)\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\\cb(mol)\,\,\,\,1 - x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1 - x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\\{K_{Cb}} = \dfrac{{\left[ {C{H_3}COO{C_2}{H_5}} \right].\left[ {{H_2}O} \right]}}{{\left[ {C{H_3}COOH} \right]{\rm{. }}\left[ {{C_2}{H_5}OH} \right]}} = \dfrac{{{x^2}}}{{{{\left( {1 - x} \right)}^2}}} = 4 < = > x = \left[ \begin{array}{l}x = \dfrac{2}{3}(nhan)\\x = 2 > 1(loai)\end{array} \right.\\H\% = \dfrac{{n\,{\,_{phan\,\,ung}}}}{{n\,{\,_{ban\,\,dau}}}}.100 = \dfrac{{2/3}}{1}.100 = 66,7\% \end{array}\]
Khi đun nóng 25,8 gam hỗn hợp gồm ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14.08 gam este. Nếu đốt cháy hoàn toàn hỗn hợp ban đầu đó thu được 23,4 ml nước. Hiệu suất của phản ứng este hóa là
Tóm tắt quá trình:
\(25,8\;(g)\;\left\{ \begin{array}{l}C{H_3}COOH\\{C_2}{H_5}OH\end{array} \right. \Rightarrow \) \(\left\{ \begin{align}& \xrightarrow{{{H}_{2}}S{{O}_{4~}}}\underbrace{C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}}_{0,16\;mol}+{{H}_{2}}O \\ & \xrightarrow{+\;{{O}_{2}}}{{H}_{2}}O:{{n}_{{{H}_{2}}O}}=\dfrac{{{m}_{{{H}_{2}}O}}}{18}=\dfrac{{{D}_{{{H}_{2}}O}}.V}{18}=\frac{23,4.1}{18}=1,3\ mol \\ \end{align} \right.\)
Gọi\(\left\{ \begin{array}{l}{C_2}{H_5}OH:x\\C{H_3}COOH:y\end{array} \right. \to \left\{ \begin{array}{l}46x + 60y = 25,8\\3x + 2y = 1,3\end{array} \right. \to \left\{ \begin{array}{l}x = 0,3\\y = 0,2\end{array} \right. \Rightarrow H = \dfrac{{0,16}}{{0,2}}.100\% = 80\% \)
Cho 0,3 mol axit X đơn chức trộn với 0,25 mol ancol etylic đem thực hiện phản ứng este hóa thu được thu được 18 gam este. Tách lấy lượng ancol và axit dư cho tác dụng với Na thấy thoát ra 2,128 lít H2. Vậy công thức của axit và hiệu suất phản ứng este hóa là
\(\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,RCOOH + {C_2}{H_5}OH \overset {{H_2}S{O_4}} \leftrightarrows RCOO{C_2}{H_5} + {H_2}O\)\(\begin{array}{l}\\bd(mol)\,\,0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,25\\pu(mol)\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x = \dfrac{{18}}{{{M_R} + 73}}\\cb(mol)\,\,0,3 - x\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,25 - x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\\{n_{ancol}} + {n_{axit\,\,du}} = 2{n_{H2}} = 0,19\,\,mol < = > (0,25 - x) + (0,3 - x) = 0,19 = > x = 0,18\\Do\,\,{n_{ancol}} < {n_{{\rm{ax}}it}} = > H\% = \dfrac{{n\,{\,_{ancol\,\,\,phan\,\,ung}}}}{{n\,{\,_{ancol\,\,\,ban\,\,dau}}}}.100 = 72\% \\ = > {M_R} = 27: - {C_2}{H_3}\\ = > {\rm{Ax}}it:C{H_2} = CHCOOH\end{array}\)
Thủy phân 0,2 mol etyl axetat trong môi trường axit với hiệu suất phản ứng bằng 80%. Khối lượng ancol tạo ra có giá trị là :
\(\begin{align}C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}+{{H}_{2}}O\overset{H2SO4}\leftrightarrows C{{H}_{3}}COOH+{{C}_{2}}{{H}_{5}}OH \\(mol)\,\,\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to 0,2 \\\end{align}\).
\(H\% = \dfrac{{m\,{\,_{thuc.te}}}}{{m\,{\,_{ly\,thuyet}}}}.100 = > m\,{\,_{thuc.te}} = m\,{\,_{ly\,thuyet}}.\dfrac{{H\% }}{{100}} = 0,2.46.\frac{{80}}{{100}} = 7,36gam\)
X là hỗn hợp gồm HCOOH và CH3COOH (tỉ lệ mol 1:1). Lấy 21,2 gam X tác dụng với 23 gam C2H5OH (xúc tác H2SO4 đặc, đun nóng) thu được m gam hỗn hợp este (hiệu suất este hóa đều đạt 80%). Giá trị m là
\(\begin{gathered}\underbrace {\left\{ \begin{gathered}HCOOH:a\,mol \hfill \\C{H_3}COOH:amol \hfill \\ \end{gathered} \right.}_{21,2(gam)}\xrightarrow{{{C_2}{H_5}OH:0,5mol}}\underbrace {\left\{ \begin{gathered}HCOO{C_2}{H_5}:a \hfill \\C{H_3}COO{C_2}{H_5}:a \hfill \\ \end{gathered} \right.}_{m(gam)} + {H_2}O \hfill \\= > a = 0,2mol \hfill \\ \end{gathered} \)
Nx: nhh axit < n ancol => Este tính theo axit.
=> m lý thuyết = 0,2.74 + 0,2.88 = 32,4 gam.
\(m\,{\,_{thuc.te}} = m\,{\,_{ly\,thuyet}}.\dfrac{{H\% }}{{100}} = 32,4.\dfrac{{80}}{{100}} = 29,52gam\)
Hỗn hợp A gồm axit axetic và etanol. Chia A thành ba phần bằng nhau.
+ Phần 1 tác dụng với Kali dư thấy có 3,36 lít khí thoát ra.
+ Phần 2 tác dụng với Na2CO3 dư thấy có 1,12 lít khí CO2 thoát ra. Các thể tích khí đo ở đktc.
+ Phần 3 được thêm vào vài giọt dung dịch H2SO4, sau đó đun sôi hỗn hợp một thời gian. Biết hiệu suất của phản ứng este hoá bằng 60%. Khối lượng este tạo thành là bao nhiêu?
\(\left\{ \begin{gathered}C{H_3}COOH:a(mol) \hfill \\{C_2}{H_5}OH:b(mol) \hfill \\ \end{gathered} \right.\left. {\left| \begin{gathered}\xrightarrow{K}{H_2}:0,15mol \hfill \\\xrightarrow{{N{a_2}C{O_3}}}C{O_2}:0,05mol \hfill \\ \end{gathered} \right.} \right\} \Rightarrow \left\{ \begin{gathered}{\text{a + b = 0,15}}{\text{.2}} \hfill \\a = 2.0,05 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}a = 0,1 \hfill \\b = 0,2 \hfill \\ \end{gathered} \right.\)
\({\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} C{H_3}COOH + {C_2}{H_5}OH\mathop \leftrightarrows \limits^{{H_2}S{O_4}} C{H_3}COO{C_2}{H_5} + {H_2}O\)
\(\begin{align}& bd(mol)\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2 \\ & pu(mol)\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to 0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to 0,1 \\ & cb(mol)\,\,\,\,0\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1 \\ & m{{\,}_{ly\,thuyet}}=0,1.88=8,8gam \\ & m\,{{\,}_{thuc.te}}=m\,{{\,}_{ly\,thuyet}}.\dfrac{H%}{100}=8,8.\dfrac{60}{100}=5,28gam \\ \end{align}\)
Hỗn hợp X gồm một ancol và một axit cacboxylic đều no đơn chức và mạch hở có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn 25,62gam X thu được 25,872 lít khí CO2 (đktc). Đun nóng 25,62gam X với xúc tác H2SO4 đặc thu được m gam este (giả sử hiệu suất phản ứng este hóa bằng 60%). Giá trị của m gần nhất với giá trị nào sau đây:
$\left. \begin{array}{l}{C_n}{H_{2n + 2}}O:x\\{C_n}{H_{2n}}{O_2}:y\end{array} \right\} = > \,hpt\left\{ \begin{array}{l}n(x + y) = 1,155\\(14n + 18)x + (14n + 32)y = 25,62\end{array} \right.$
=> M trung bình = 22,2n
=> (14n + 18) < 22,2n < 14n + 32
=> 2,2 < n < 3,9 => n = 3
=> C3H8O (0,205 mol), C3H6O2 (0,18 mol)
=> n este = nC3H6O2 . h% = 0,108mol
=> m C2H5COOC3H7 = 12,528g
Đun nóng ancol isoamylic (CH3)2CHCH2CH2OH với axit axetic có H2SO4 đặc xúc tác thu được isoamyl axetat (dầu chuối). Tính khối lượng dầu chuối thu được từ 132,25 g axit axetic đun nóng với 200 g ancol isoamylic? Biết hiệu suất phản ứng đạt 68%.
\(\begin{array}{l}{{\rm{n}}_{{\rm{ax}}it}} = \dfrac{{132,25}}{{60}}mol\\{n_{ancol}} = \dfrac{{200}}{{88}}mol\end{array}\)
\({\left( {C{H_3}} \right)_2}CHC{H_2}C{H_2}OH + C{H_3}COOH\overset {{H_2}S{O_4}} \leftrightarrows C{H_3}COOC{H_2}C{H_2}CH{(C{H_3})_2} + {H_2}O\)
\(\begin{array}{l}Nx:\dfrac{{132,25}}{{60}} < \dfrac{{200}}{{88}} = > {n_{{\rm{es}}te}} = \dfrac{{132,25}}{{60}}mol\\m\,{\,_{thuc.te}} = m\,{\,_{ly\,thuyet}}.\dfrac{{H\% }}{{100}}\\ = > {{\rm{m}}_{{\rm{es}}te}} = \dfrac{{132,25}}{{60}}.130.\dfrac{{68}}{{100}} = 194,84 \approx 195g\end{array}\)
Từ 1 gam đất đèn (trong đó có chứa 96% canxi cacbua) điều chế ra axit axetic, theo tính toán ta có hiệu suất toàn quá trình điều chế axit đạt 80%. Lấy toàn bộ lượng axit thu được cho tham gia phản ứng este hóa với lượng dư ancol etylic. Ta có hiệu suất phản ứng este hóa là 90%. Hãy tính khối lượng este etyl axetat.
$\begin{align}& {{n}_{Ca{{C}_{2}}}}=\frac{0,96}{64}=0,015mol \\ & m\,{{\,}_{thuc.te}}=m\,{{\,}_{ly\,thuyet}}.\frac{H%}{100} \\ & H={{H}_{1}}.{{H}_{2}} \\ \end{align}$
$\begin{align}& Ca{{C}_{2}}\xrightarrow{80%}C{{H}_{3}}\text{COO}H\xrightarrow{90%}C{{H}_{3}}\text{COO}{{C}_{2}}{{H}_{5}} \\ & 0,015\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to 0,015\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to 0,015 \\ & {{\text{m}}_{\text{este}}}\text{=0,015}\text{.88}\text{.}\frac{\text{80}\text{.90}}{100.100}\text{=0,9504g} \\ \end{align}$
Muốn tổng hợp 120 kg Poli metylmetacrylat, hiệu suất quá trình este hóa và trùng hợp lần lượt là 60% và 80%, khối lượng axit và ancol cần dùng lần lượt là :
CH2=C(CH3)COOH + CH3OH → CH2=C(CH3)COOCH3 → Trùng hợp
=> nmắt xích = neste = 1,2 kmol
=> nancol = naxit = 1,2 . 100/60 . 100/80 = 2,5 kmol
=> mancol = 80kg ; maxit = 215 kg
Hỗn hợp A gồm 1 axit no đơn chức và một axit không no đơn chức có một liên kết đôi ở gốc hiđrocacbon. Khi cho a gam A tác dụng hết với CaCO3 thoát ra 1,12 lít CO2 (đktc). Hỗn hợp B gồm CH3OH và C2H5OH khi cho 7,8 gam B tác dụng hết Na thoát ra 2,24 lít H2 (đktc). Nếu trộn a gam A với 3,9 gam B rồi đun nóng có H2SO4 đặc xúc tác thì thu được m gam este (hiệu suất h%). Giá trị m theo a, h là
\(\begin{align}& \text{Ax}it\,\,RCOOH:a(mol)\xrightarrow{+CaCO3}C{{O}_{2}}:0,05mol \\ & 2\text{ }R-COOH\text{ }+\text{ }CaC{{O}_{3}}\text{ }\to \text{ }{{\left( R-COO \right)}_{2}}-Ca\text{ }+\text{ }C{{O}_{2}}\text{ }+\text{ }{{H}_{2}}O \\ \end{align}\)
\({n_{RCOOH}} = 2{n_{CO2}} = 0,1mol\)
\(\begin{align}& Ancol\,\,\overline{R}OH:b(mol)\xrightarrow{+Na}{{H}_{2}}:0,1mol \\ & \overline{R}OH+Na\to \overline{R}ONa+\frac{1}{2}{{H}_{2}} \\ \end{align}\)
\({n_{\overline R OH}} = 2{n_{H2}} = 0,2mol\)
\(\underbrace{A:RCOOH}_{a(gam):0,1mol}+\underbrace{B:\overline{R}OH}_{3,9(gam):0,1mol}\xrightarrow{h%}\underbrace{RCOO\overline{R}}_{m(gam)}+{{H}_{2}}O\)
\(BTKL:(a + 3,9).h\% = m + 18.0,1.h\% = > m = (a + 2,1)h\% \)
Hỗn hợp M gồm ancol no, đơn chức X và axit cacboxylic đơn chức Y, đều mạch hở và có cùng số nguyên tử C, tổng số mol của hai chất là 0,5 mol (số mol của Y lớn hơn số mol của X). Nếu đốt cháy hoàn toàn M thì thu được 33,6 lít khí CO2 (đktc) và 25,2 gam H2O. Mặt khác, nếu đun nóng M với H2SO4 đặc để thực hiện phản ứng este hoá (hiệu suất là 80%) thì số gam este thu được là
\(\begin{array}{l}{n_{CO2}} = 1,5mol\\{n_{H2O}} = 1,4mol\\{n_{CO2}} > {n_{H2O}} = > {\rm{Este \, ko}}\,{\rm{no}}\\M\left\{ \begin{array}{l}X:ROH:{C_n}{H_{2n + 2}}O:a(mol)\\Y:R'C{\rm{OO}}H:{C_n}{H_{2n - 2}}{O_2}:b(mol;b > a)\end{array} \right.\end{array}\)
\(\left\{ \begin{gathered}{C_n}{H_{2n + 2}}O:a(mol) \hfill \\{C_n}{H_{2n - 2}}{O_2}:b(mol) \hfill \\ \end{gathered} \right.\xrightarrow{{ + O2}}\left\{ \begin{gathered}C{O_2}:1,5{\mkern 1mu} {\mkern 1mu} mol \hfill \\{H_2}O:1,4{\mkern 1mu} {\mkern 1mu} mol \hfill \\ \end{gathered} \right.\)
\( = > \left\{ \begin{gathered}a + b = 0,5 \hfill \\\xrightarrow{{BTNT:C}}an + bn = 1,5 \hfill \\\xrightarrow{{BTNT:H}}a(n + 1) + b(n - 1) = 1,4 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}a = 0,2 \hfill \\b = 0,3 \hfill \\n = 3 \hfill \\ \end{gathered} \right.\)
\(\begin{array}{l}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{C_3}{H_7}OH + {C_2}{H_3}COOH \to {C_2}{H_3}COO{C_3}{H_7} + {H_2}O\\bd(mol)\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,3\\pu(mol)\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to 0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to 0,2\\m\,{\,_{thuc.te}} = m\,{\,_{ly\,thuyet}}.\dfrac{{H\% }}{{100}}\\{{\rm{m}}_{{\rm{es}}te}} = 0,2.114.\dfrac{{80}}{{100}} = 18,24gam\end{array}\)
Hỗn hợp X gồm một ancol và một axit cacboxylic đều no, đơn chức, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn 51,24 gam X, thu được 101,64 gam CO2. Đun nóng 51,24 gam X với xúc tác H2SO4 đặc, thu được m gam este (hiệu suất phản ứng este hóa bằng 60%). Giá trị m gần nhất với giá trị nào sau đây?
Gọi số mol ancol và axit lần lượt là x và y
Vì 2 chất đều no đơn chức nên khi đốt cháy : nH2O = nCO2 + nancol = 2,31 + x
Bảo toàn O : 2.nO2 + nancol + 2naxit = 2.nCO2 + nH2O => nO2= (3,465 – y) mol
Bảo toàn khối lượng : mX + mO2 = mCO2 + mH2O
=> 9x + 16y = 9,45 => 9(x+y) < 9,45 < 16(x+y)
=> 0,59 < (x + y) < 1,05
Gọi số C trong mỗi chất là n => nCO2 = 2,31 = n.(x + y) => (x + y) = 2,31/n
=> 2,2 < n < 3,9 =>n = 3
=> x = 0,41 ; y = 0,36 mol
C2H5COOH + C3H7OH → C2H5COOC3H7 + H2O
0,36 0,41 →0,36
=> Tính theo chất phản ứng thiếu (axit) => neste = naxit = 0,36 mol
=> \(m\,{\,_{thuc.te}} = m\,{\,_{ly\,thuyet}}.\dfrac{{H\% }}{{100}} = 25,056gam\)
Đun 13,80 gam rượu etylic với một lượng dư axit axetic (có H2SO4 đặc làm xúc tác). Khi phản ứng dừng lại thu được 11,00 gam este. Hiệu suất của phản ứng este hoá là
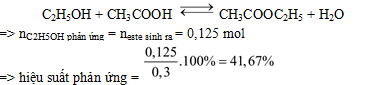
Hỗn hợp M gồm 2 axit cacboxylic no, mạch hở (phân tử chỉ chứa nhóm chức –COOH) và một ancol no, mạch hở. Đốt cháy hoàn toàn m gam M thu được CO2 và 10,8 gam H2O. Nếu đun nóng m gam M trên (với xúc tác H2SO4 đặc) thấy các chất trong hỗn hợp phản ứng với nhau vừa đủ, chỉ thu được H2O và este X (phân tử chỉ chứa chức este, giả thiết phản ứng este hóa đạt hiệu suất 100%). Để đốt cháy hoàn toàn lượng X sinh ra thì cần dùng vừa đủ 0,5625 mol O2 thu được hỗn hợp CO2 và H2O thỏa mãn điều kiện 3nX phản ứng = nCO2 - nH2O. Công thức phân tử của X là
Các axit và ancol đều no nên X là este no.
3nX phản ứng = nCO2 - nH2O => X có k = 4 (dựa vào công thức: nX = (nCO2-nH2O)/(k-1))
X tạo bởi 2 axit và 1 ancol nên X có 3 nhóm COO và 1 vòng
Giả sử X có công thức: B(COO)2(ACOO)R (a mol)
=> M gồm ACOOH (a mol); B(COOH)2 (a mol), R(OH)3 (a mol)
Quy đổi hỗn hợp M thành HCOOH (a); (COOH)2 (a); C3H5(OH)3 (a) và CH2 (b)
+ nH2O = a + a + 4a + b = 0,6
Lượng O2 dùng để đốt X cũng như đốt M nên:
+ nO2 = 0,5a + 0,5a + 3,5a + 1,5b = 0,5625
Giải hệ trên thu được a = 0,075 và b = 0,15
Do b = 2a nên X là HCOO(COO)2C3H5.2CH2
=> X là C8H10O6

