Điện phân 200 ml dung dịch CuCl2 sau một thời gian người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm đinh sắt sạch trong dung dịch còn lại sau khi điện phân, phản ứng xong thấy khối lượng đinh sắt tăng 1,2 gam. Nồng độ mol ban đầu của dung dịch CuCl2 là
Ta có: \({n_{C{l_2}}} = \frac{{1,12}}{{22,4}} = 0,05 (mol)\)
Vì sau phản ứng đem ngâm đinh sắt sạch trong dung dịch thấy khối lượng đinh sắt tăng lên nên dung dịch sau điện phân có chứa CuCl2 → CuCl2 chưa điện phân hết
- Phản ứng điện phân dung dịch:
CuCl2 \(\xrightarrow{{dpdd}}\) Cu + Cl2
→ nCu (đp) = nCl2 = 0,05 mol
- Nhúng thanh Fe vào dd sau điện phân:
Gọi số mol CuCl2 còn dư sau điện phân là x (mol)
CuCl2 + Fe → Cu + FeCl2
x → x → x (mol)
Ta có: ∆m = mCu - mFe pư ⟹ 64x - 56x = 1,2 ⟹ x = 0,15
Vậy: nCu (ban đầu) = 0,05 + 0,15 = 0,2 (mol)
\( \to {C_{M CuC{l_2}}} = \frac{{0,2}}{{0,2}} = 1(M)\)
Cho 19,2 g Cu vào dung dịch loãng chứa 0,4 mol HNO3, phản ứng xảy ra hoàn toàn thì thể tích khí NO (đktc) thu được là
\({n_{Cu}} = 0,3 mol; {n_{HN{O_3}}} = 0,4 mol{\rm{ }}\)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Ban đầu: 0,3 0,4 (ta thấy: \(\frac{{0,3}}{3} > \frac{{0,4}}{8}\) → HNO3 là chất hết)
Pư: 0,15 ← 0,4 → 0,1 (mol)
⟹ VNO = 0,1.22,4 = 2,24 lít
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau:
- Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H2.
- Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2.
Các thể tích khí đo ở đktc. Phần trăm khối lượng của Cu có trong hỗn hợp là
Chia đôi hỗn hợp nên khối lượng mỗi phần là 2 gam.
Phần 1:
(1) 2Al + 6HCl → 2AlCl3 + 3H2
(2) Fe + 2HCl → FeCl2 + H2
Phần 2:
(3) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Từ pt (3): \({n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.\frac{{0,336}}{{22,4}} = 0,01\left( {mol} \right) \to {m_{Al}} = 0,27g\)
Theo (1), (2) và (3) ta có: \({V_{{H_2}\left( 2 \right)}} = 560 - 336 = 224\left( {ml} \right)\)
Theo (2) ta có: \({n_{Fe}} = {n_{{H_2}}} = \frac{{0,224}}{{22,4}} = 0,01\left( {mol} \right) \to {m_{Fe}} = 0,56\left( g \right)\)
→ mCu = mhỗn hợp - (mAl + mFe) = 2 - 0,27 - 0,56 = 1,17 (g)
\( \to \% {m_{Cu}} = \frac{{1,17}}{2}.100\% = 58,5\% \)
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và 224 ml khí NO duy nhất (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
Do kim loại còn dư sau phản ứng nên HNO3 phản ứng hết.
Ta có bán phản ứng sau: 4H+ + NO3- + 3e → NO + 2H2O
\( \to {n_{{H^ + }}} = 4{n_{NO}} = 4.\frac{{0,224}}{{22,4}} = 0,04\left( {mol} \right)\)
\( \to {n_{HN{O_3}}} = 0,04{\kern 1pt} mol \to {C_{M\left( {HN{O_3}} \right)}} = \frac{{0,04}}{{0,2}} = 0,2\left( M \right)\)
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
Ta có sơ đồ phản ứng: {FeS2, Cu2S} + HNO3 → Fe2(SO4)3 + CuSO4 + NO + H2O
Bảo toàn nguyên tố Fe ta có: \({n_{F{{\rm{e}}_2}{{\left( {S{O_4}} \right)}_3}}} = \frac{1}{2}{n_{F{\rm{e}}{{\rm{S}}_2}}} = \frac{1}{2}.0,12 = 0,06\left( {mol} \right)\)
Bảo toàn nguyên tố Cu ta có: \({n_{CuS{O_4}}} = 2{n_{C{u_2}S}} = 2{\rm{a}}\left( {mol} \right)\)
Bảo toàn nguyên tố S có: \({n_{S\left( {F{\rm{e}}{{\rm{S}}_2},C{u_2}S} \right)}} = {n_{S\left( {muoi\,sunf{\rm{a}}t} \right)}}\)
\( \to 2{n_{F{\rm{e}}{{\rm{S}}_2}}} + {n_{C{u_2}S}} = 3{n_{F{{\rm{e}}_2}{{\left( {S{O_4}} \right)}_3}}} + {n_{CuS{O_4}}}\)
→ 2.0,12 + a = 3.0,06 + 2a → a = 0,06 mol
Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí O2 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
Ta có: \({n_{Cu}} = \frac{{19,2}}{{64}} = 0,3\left( {mol} \right)\)
- Phương pháp thông thường:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,3 → 0,2 (mol)
2NO + O2 → 2NO2
0,2 → 0,1 → 0,2 (mol)
4NO2 + O2 + 2H2O → 4HNO3
0,2 → 0,05 (mol)
\( \to {n_{{O_2}}} = 0,1 + 0,05 = 0,15\left( {mol} \right)\)
\( \to {V_{{O_2}}} = 0,15.22,4 = 3,36\left( l \right)\)
- Phương pháp bảo toàn electron:
Trong quá trình phản ứng trên thì Cu nhường electron và O2 thu electron. Còn N+5 trong HNO3 chỉ vận chuyển electron nên ta có:
Quá trình nhường electron:
Cu0 → Cu+2+ 2e
0,3 → 0,6 (mol)
Quá trình thu electron:
O2 + 4e → 2O-2
x → 4x (mol)
Áp dụng bảo toàn e: 4x = 0,6 → x = 0,15 (mol)
\( \to {V_{{O_2}}} = 0,15.22,4 = 3,36\left( l \right)\)
Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muối khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
Các PTHH:
- Hòa tan hỗn hợp Ag2O, Cu vào dung dịch HNO3 loãng, dư:
Ag2O + 2HNO3 → 2AgNO3 + H2O
0,1 → 0,2 (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,2 → 0,2 (mol)
→ Muối khan A có chứa: AgNO3 (0,2 mol) và Cu(NO3)2 (0,2 mol)
- Nung muối A đến khối lượng không đổi:
2AgNO3 \(\xrightarrow{{{t^o}}}\) 2Ag + 2NO2 + O2
0,2 → 0,2 (mol)
Cu(NO3)2 \(\xrightarrow{{{t^o}}}\) CuO + NO2 + O2
0,2 → 0,2 (mol)
→ Chất rắn B thu được gồm Ag (0,2 mol) và CuO (0,2 mol)
→ mB = 0,2.108 + 0,2.80 = 37,6 (g)
Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (giả sử hiệu suất của các phản ứng là 100%) là
- Cho H2 qua bột CuO đun nóng: CuO + H2 → Cu + H2O
\( \to {n_{{H_2}}} = {n_{Cu}} = \frac{{32}}{{64}} = 0,5\left( {mol} \right)\)
- Cho H2 qua bột FeO đun nóng: FeO + H2 → Fe + H2O
\( \to {n_{F{\rm{e}}}} = {n_{{H_2}}} = 0,5\left( {mol} \right)\)
- Khối lượng Fe thu được là: mFe = 0,5.56 = 28 (g)
Hoà tan hoàn toàn 9,6 gam Cu bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
Theo PTHH ta có: nNO = 2/3.nCu = 2/3.0,15 = 0,1 (mol)
Vậy VNO = 0,1.22,4 = 2,24 (lít)
Khử hết m gam CuO bằng H2 dư, thu được chất rắn X. Cho X tan hết trong dung dịch HNO3 dư thu được 2,24 lít khí NO (sản phẩm khử duy nhất của N+5). Giá trị của m là:
Các phương trình hóa học xảy ra:
CuO + H2 → Cu + H2O (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
Theo (2) =>nCu = 3/2.nNO = 3/2 . 0,1 = 0,15 mol
Theo (1) => nCuO = nCu = 0,15 mol
=> mCuO = 0,15.80 = 12 (g)
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Đặt mol của Cu và Fe3O4 lần lượt là 3x và x (mol)
→ m hỗn hợp = 64.3x + 232.x = 42,4 → x = 0,1 mol
PTHH:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
0,1 → 0,2 (mol)
Cu + 2FeCl3 → CuCl2 + 2FeCl2
0,1 ← 0,2 (mol)
→ nCu dư = 0,3 - 0,1 = 0,2 mol
→ m chất rắn = mCu dư = 0,2.64 = 12,8 gam
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Đặt mol của Cu và Fe3O4 lần lượt là 3x và x (mol)
→ m hỗn hợp = 64.3x + 232.x = 42,4 → x = 0,1 mol
PTHH:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
0,1 → 0,2 (mol)
Cu + 2FeCl3 → CuCl2 + 2FeCl2
0,1 ← 0,2 (mol)
→ nCu dư = 0,3 - 0,1 = 0,2 mol
→ m chất rắn = mCu dư = 0,2.64 = 12,8 gam
Hòa tan hoàn toàn 7,6 gam chất rắn X gồm Cu, Cu2S và S bằng dung dịch HNO3 dư thấy thoát ra 5,04 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y được m gam kết tủa. Giá trị của m là
Tóm tắt:
\(7,6\,(g)\,X\left\{ \matrix{
Cu:a\,(mol) \hfill \cr
S:\,b(mol) \hfill \cr} \right.\buildrel { + HN{O_3}\,\,du} \over
\longrightarrow \left\{ \matrix{
NO:{{5,04} \over {22,4}} = 0,225\,(mol) \hfill \cr
\left\{ \matrix{
C{u^{2 + }} \hfill \cr
S{O_4}^{2 - } \hfill \cr
{H^ + } \hfill \cr
N{O_3}^ - \hfill \cr} \right.\buildrel { + \,\,Ba{{(OH)}_2}\,du} \over
\longrightarrow m(g) = ?\left\{ \matrix{
BaS{O_4} \hfill \cr
Cu{(OH)_2} \hfill \cr} \right. \hfill \cr} \right.\)
Quy đổi X thành Cu (a) và S (b)
→ mX = 64a + 32b = 7,6 (I)
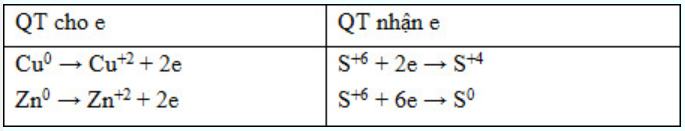
quá trình nhường e quá trình nhận e
Cu → Cu+2 +2e N+5 +3e → N+3
a → 2a (mol) 0,675 ← 0,225 (mol)
S0 → S+6 + 6e
b → 6b (mol)
Bảo toàn electron: 2a + 6b = 0,675 (II)
giải hệ (I) và (II) → a = 0,075; b = 0,0875
→ nCu = 0,075 (mol) và nS = 0,0875 (mol)
BTNT “S”: nBaSO4 = nS = 0,0875 (mol)
BTNT “Cu”: nCu(OH)2 = nCu = 0,075 (mol)
→ m↓ = mBaSO4 + mCu(OH)2 = 0,0875.233 + 0,075.98 = 27,7375 (g)
Cho 1,68 gam bột sắt và 0,36 gam Mg tác dụng với 375 ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82 gam. Nồng độ mol/l của CuSO4 trong dung dịch trước phản ứng là
nMg = 0,36 : 24 = 0,015 (mol); nFe = 1,68 : 56 = 0,03 (mol)
Cho hh Mg và Fe vào dd CuSO4 phản ứng xảy ra theo thứ tự:
Mg + CuSO4 → MgSO4 + Cu↓ (1)
Fe + CuSO4 → FeSO4 + Cu↓ (2)
- Nếu Mg phản ứng hết:
Theo (1): nCu = nMg = 0,015 (mol) → mKL thu được = mCu(1) + mFe = 0,015.64 + 1,68 = 2,64 (g)
- Nếu cả Mg và Fe pư hết:
Theo (1) và (2): ∑ nCu = nMg + nFe = 0,015 + 0,03 = 0,045 (mol) → mKL thu được = mCu = 0,045.64 = 2,88 (g)
Theo bài 2,64 (g) < mKL thu được = 2,82 (g) < 2,88 (g)
Vậy Mg phản ứng hết, Fe mới phản ứng một phần.
Đặt nFe pư = x (mol)
Theo PTHH (1): nCu = nMg = 0,015 (mol)
Theo PTHH (2): nCu = nFe pư = x (mol)
→ mKL thu được = mCu(1)+(2) + mFe dư
→ 64(0,015 + x) + 1,68 – 56x = 2,82
→ x = 0,0225
→ ∑ nCu = 0,015 + 0,0225 = 0,0375 (mol)
BTNT “Cu”: nCuSO4 = nCu = 0,0375 (mol)
→ CM CuSO4 = nCuSO4 : VCuSO4 = 0,0375 : 0,375 = 0,1 (M)
Cho hỗn hợp bột hai kim loại Mg, Cu vào cốc đựng dung dịch HCl (vừa đủ) thu được chất khí X, dung dịch chứa muối Y và chất rắn không tan Z. Các chất X, Y, Z lần lượt là
Mg, Cu cho tác dụng với dd HCl chỉ có Mg pư, Cu không pư → rắn không tan Z là Cu
PTHH: Mg + 2HCl → MgCl2 + H2↑
→ Khí X là H2; dd Y là MgCl2
Chia 1,6 lít dung dịch Cu(NO3)2 và HCl làm 2 phần bằng nhau.
- Phần 1: Điện phân với điện cực trơ với I = 2,5A sau thời gian t giây thu được 0,14 mol một khí duy nhất ở anot. Dung dịch sau điện phân phản ứng vừa đủ với 550 ml dung dịch NaOH 0,8M được 1,96g kết tủa.
- Cho m gam bột Fe vào phần 2 đến khi phản ứng xảy ra hoàn toàn thu được 0,7m gam hỗn hợp kim loại và V lít khí NO (sản phẩm khử duy nhất ở đktc)
Giá trị của m và V lần lượt là:
- Phần 1:
Vì dung dịch sau điện phân + NaOH tạo kết tủa => Cu2+dư và khí duy nhất chính là Cl2
nCl2 = 0,14 mol
Catot: Cu2+ +2e → Cu
Anot: 2Cl- → Cl2 + 2e
- Khi + NaOH:
OH- + H+ → H2O
2OH- + Cu2+ → Cu(OH)2
nCu2+ dư = nCu(OH)2 = 1,96: 98 = 0,02 mol
nH+ dư = nNaOH – 2nCu(OH)2 = 0,55.0,8 – 2.0,02 = 0,4 mol = nHCl
(Vì H+ dư nên Cu2+ chưa điện phân hết)
Bảo toàn e: ne = 2nCu2+ = 2nCl2 => nCu2+ pứ = nCl2 = 0,14 mol
=> nCu(NO3)2 = 0,14 + 0,02 = 0,16 mol
- Phần 2: Vì thu được hỗn hợp kim loại => Fe dư => dung dịch chỉ có Fe2+
Các phản ứng:
2Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Mol 0,15 0,4 0,1 0,15 0,1
Fe + Cu2+ → Fe2+ + Cu
Mol 0,16 0,16 0,16
Gọi nFe dư = a => 0,16.64 + 56a = 0,7.56.(a + 0,15 + 0,16)
=> a = 239/2100 => mFe = (239/2100 + 0,31).56 = 23,73g
=> VNO = 0,1.22,4 = 2,24 lít
Hòa tan hoàn toàn 12,9 gam hỗn hợp Cu, Zn bằng dung dịch H2SO4 đặc, nóng thu được sản phẩm khử là 3,136 lít SO2 (đktc) và 0,64 gam lưu huỳnh. Phần trăm khối lượng của Cu trong hỗn hợp ban đầu là
nSO2 = 0,14 mol; nS = 0,02 mol
Đặt nCu = x mol và nZn = y mol
+ m hh = 64x + 65y = 12,9 (1)
+ Bảo toàn electron:

Áp dụng bảo toàn electron: 2nCu + 2nZn = 2nSO2 + 6nS => 2x + 2y = 2.0,14 + 6.0,02 (2)
Giải hệ (1) và (2) được: x = 0,1 và y = 0,1
=> %mCu = 0,1.64/12,9.100% = 49,61%
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưỡng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Ta có: nHNO3 = 44,1: 63 = 0,7 mol
Ta có: mCu = 0,7m và mFe = 0,3m
Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m
Ta có: nNO + nNO2 = 0,25 mol (1)
Quá trình nhận electron:
NO3-+ 1e + 2H+ → NO2 + H2O
NO3-+ 3e + 4H+ → NO + 2H2O
Ta có: nH+ = 2.nNO2 + 4.nNO = 0, 7 mol (2)
Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol
Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là:
Fe → Fe2+ + 2e
Áp dụng định luật bảo toàn electron ta có:
2.nFe = nNO2 + 3.nNO = 0,15 + 3.0,1 = 0,45 mol
→ nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam
Hòa tan hoàn toàn 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Cu(NO3)2 và Fe(NO3)3 trong X lần lượt là:
Nếu KOH phản ứng hết thì T chứa KNO2:
nKNO2 = nKOH = 0,5 mol => m chất rắn = 0,5.101 = 50,5 gam > 41,05 (g) (vô lí) => KOH dư
- Đặt T gồm: KOH dư (a mol) và KNO2 (b mol)
+ BTNT "K": nKOH = nKOH dư + nKNO2 => a + b = 0,5
+ m chất rắn = 56a + 85b = 41,05=> a = 0,05 và b = 0,45
BTNT "N": nKNO2 = nNO3- (dd X) = 0,45 mol
- Đặt A gồm: Fe (x mol) và Cu (y mol)
+ mA = 56x + 64y = 11,6
+ mFe2O3 + mCuO = 160.0,5x + 80y = 16=> x = 0,15 và y = 0,05
TH1: Giả sử dd X chứa: Fe3+ (0,15), Cu2+ (0,05), H+ và NO3- (0,45)
\(11,6(g)A\left\{ \begin{gathered}
Fe:x \hfill \\
Cu:y \hfill \\
\end{gathered} \right. + HN{O_3}:0,7 \to \left| \begin{gathered}
{\text{dd}}\,X\left\{ \begin{gathered}
F{e^{2 + }}:u \hfill \\
F{e^{3 + }}:v \hfill \\
C{u^{2 + }}:0,05 \hfill \\
N{O_3}^ - :0,45 \hfill \\
\end{gathered} \right.\xrightarrow{{ + KOH:0,5}}\left\{ \begin{gathered}
\downarrow Y\xrightarrow{{Nung}}\underbrace {\left\{ \begin{gathered}
F{e_2}{O_3}:0,5x \hfill \\
CuO:y \hfill \\
\end{gathered} \right.}_{16(g)} \hfill \\
{\text{dd}}\,Z\xrightarrow{{Co\,can}}T\xrightarrow{{Nung}}\underbrace {\left\{ \begin{gathered}
KOH:0,05 \hfill \\
KN{O_2}:0,45 \hfill \\
\end{gathered} \right.}_{41,05(g)} \hfill \\
\end{gathered} \right. \hfill \\
\hfill \\
Khi\,B \hfill \\
{H_2}O \hfill \\
\end{gathered} \right.\)
BTĐT => nH+ = nNO3- - 2nFe3+ - 2nCu2+ = 0,45 - 0,15.3 - 0,05.2 = -0,1 < 0 (loại)
TH2: Dung dịch X chứa: Fe2+ (u); Fe3+ (v); Cu2+ (0,05) và NO3- (0,45)
+ BTĐT: 2u + 3v + 2.0,05 = 0,45
+ BTNT "Fe": u + v = 0,15
Giải hệ được u = 0,1 và v = 0,05
BTNT H: nH2O = 0,5.nHNO3 = 0,35 mol
BTNT "N": nN(B) = nHNO3 - nNO3- = 0,7 - 0,45 = 0,25 mol
Do dd X chứa NO3- dư nên không sinh ra H2 => Khí B chỉ chứa N và O
BTNT "O": nO(B) = 3nHNO3 - 3nNO3- - nH2O = 0,7.3 - 0,45.3 - 0,35 = 0,4 mol
=> mB = mN + mO = 0,25.14 + 0,4.16 = 9,9 gam
BTKL: m dd X = mA + mdd HNO3 - mB = 11,6 + 87,5 - 9,9 = 89,2 (g)
=> C% Cu(NO3)2 = (0,05.188/89,2).100% = 10,5%;
C% Fe(NO3)3 = (0,05.242/89,2).100% = 13,6%
X là kim loại được sử dụng rất sớm (từ những năm 5000 TCN). Một học sinh đã cho kim loại X lần lượt phản ứng với các dung dịch HCl, AgNO3, FeCl2 ta thu được kết quả ở bảng sau:
| Chất | Dung dịch HCl | Dung dịch AgNO3 | Dung dịch FeCl2 |
| Kim loại X | Không phản ứng | Có phản ứng | Không phản ứng |
Cu là kim loại thỏa mãn X:
Cu + AgNO3 → Cu(NO3)2 + Ag

