Nitrogen dioxide (NO2) là nguyên liệu điều chế nhiều chất vô cơ. Hình dưới đây biểu diễn quá trình điều chế một số chất vô cơ từ nitrogen dioxide

Phát biểu nào sau đây không đúng?
(1) \(2\mathop N\limits^{ + 4} {O_2} + 7\mathop {{H_2}}\limits^0 \to 2\mathop N\limits^{ - 3} {\mathop H\limits^{ + 1} _3} + 4{H_2}O\) => A đúng
(2) \(2N{O_2} \to {N_2}{O_4}\) => Không có sự thay đổi số oxi hoá các nguyên tố => B đúng
(3) \(3\mathop N\limits^{ + 4} {O_2} + {H_2}O \to 2H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\) => C đúng
D sai. Số oxi hoá của N trong (1) giảm dần, trong (2) không thay đổi, trong (3) vừa tăng vừa giảm
Phản ứng oxi hoá – khử giữa hợp chất của kim loại M và oxalic acid (H2C2O4) trong môi trường acid xảy ra như sau:
\(2M{O_4}^ - + a{H_2}{C_2}{O_4} + b{H^ + } \to 2{M^{n + }} + cC{O_2} + d{H_2}O\)
Biết (a-d) là các số nguyên tối giản nhất. Khi 1 mol MO4- phản ứng thì số mol H2O sinh ra là n mol. Tổng (a + b + c + d) có giá trị là
\(\begin{array}{*{20}{c}}2\\{7 - n}\end{array}\left| {\begin{array}{*{20}{c}}{\mathop M\limits^{ + 7} + (7 - n)e \to \mathop M\limits^{ + n} }\\{2\mathop C\limits^{ + 3} \to 2\mathop C\limits^{ + 4} + 2e}\end{array}} \right.\)
=> \(2M{O_4}^ - + (7 - n){H_2}{C_2}{O_4} + (2 + 2n){H^ + } \to 2{M^{n + }} + (14 - 2n)C{O_2} + 8{H_2}O\)
Theo PTHH có 2 mol MnO4- tạo ra 8 mol H2O
Theo đề bài có 1 mol MnO4- tạo ra n mol H2O
=> 2n = 8 => n = 4
=> Tổng a + b + c + d = 7 – n + 2 + 2n + 14 – 2n + 8 = 31 – n = 31 – 4 = 27
Hiện nay, chlorine dioxide (ClO2) được xem là một chất khử trùng hiệu quả và không gây ô nhiễm thế hệ mới. Một trong những phương pháp công nghiệp được biết đến để điều chế chlorine dioxide là dùng methanol phản ứng với sodium chlorate trong môi trường acid theo phương trình:
\(C{H_3}OH + NaCl{O_3} + {H_2}S{O_4} \to Cl{O_2} + C{O_2} + N{a_2}S{O_4} + {H_2}O\)
Tổng hệ số nguyên của các chất trong phương trình khi cân bằng là
\(\mathop C\limits^{ - 2} {H_3}OH + Na\mathop {Cl}\limits^{ + 5} {O_3} + {H_2}S{O_4} \to \mathop {Cl}\limits^{ + 4} {O_2} + \mathop C\limits^{ + 4} {O_2} + N{a_2}S{O_4} + {H_2}O\)
\(\begin{array}{*{20}{c}}6\\1\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {Cl}\limits^{ + 5} + 1e \to \mathop {Cl}\limits^{ + 4} }\\{\mathop C\limits^{ - 2} \to \mathop C\limits^{ + 4} + 6e}\end{array}} \right.\)
\(C{H_3}OH + 6NaCl{O_3} + 3{H_2}S{O_4} \to 6Cl{O_2} + C{O_2} + 3N{a_2}S{O_4} + 5{H_2}O\)
=> Tổng hệ số cân bằng của các chất là 1 + 6 + 3 + 6 + 1 + 3 + 5 = 25
Copper (II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi, dùng để pha chế thuộc Bordaux (trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp)… Copper (II) sulfate có thể điều chế theo phản ứng sau:
\(Cu + {O_2} + {H_2}S{O_4} \to CuS{O_4} + {H_2}O\)
Tổng hệ số cân bằng tối giản của các chất trong phản ứng là
\(\mathop {Cu}\limits^0 + \mathop {{O_2}}\limits^0 + {H_2}S{O_4} \to \mathop {Cu}\limits^{ + 2} S{O_4} + {H_2}\mathop O\limits^{ - 2} \)
\(\begin{array}{*{20}{c}}2\\1\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e}\\{{O_2} + 4e \to 2\mathop O\limits^{ - 2} }\end{array}} \right.\)
=> \(2Cu + {O_2} + 2{H_2}S{O_4} \to 2CuS{O_4} + 2{H_2}O\)
=> Tổng hệ số cân bằng tối giản của các chất trong phản ứng trên là 2 + 1 + 2 + 2 + 2 = 9
Cho sơ đồ phản ứng sau: \({M_2}{O_x} + HN{O_3} \to M{(N{O_3})_3} + ....\). Phản ứng trên thuộc loại phản ứng oxi hoá – khử khi x có giá trị là
Để phản ứng trên là phản ứng oxi hoá – khử thì số oxi hoá của M trong oxit chưa đạt đến trạng thái số oxi hoá cao nhất => Giá trị x thoả mãn là 0 < x < 3
Cho phản ứng chưa cân bằng:
\(FeS{O_4} + {K_2}C{r_2}{O_7} + {H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + {K_2}S{O_4} + C{r_2}{(S{O_4})_3} + {H_2}O\)
Trong phương trình hoá học của phản ứng trên, khi hệ số của K2Cr2O7 là 2 thì hệ số của Fe2(SO4)3 là
\(\mathop {Fe}\limits^{ + 2} S{O_4} + {K_2}\mathop {C{r_2}}\limits^{ + 6} {O_7} + {H_2}S{O_4} \to \mathop {F{e_2}}\limits^{ + 3} {(S{O_4})_3} + {K_2}S{O_4} + \mathop {C{r_2}}\limits^{ + 3} {(S{O_4})_3} + {H_2}O\)
\(\begin{array}{*{20}{c}}3\\1\end{array}\left| {\begin{array}{*{20}{c}}{2\mathop {Fe}\limits^{ + 2} \to \mathop {F{e_2}}\limits^{ + 3} + 2e}\\{\mathop {C{r_2}}\limits^{ + 6} + 6e \to \mathop {C{r_2}}\limits^{ + 3} }\end{array}} \right.\)
=> \(6FeS{O_4} + {K_2}C{r_2}{O_7} + 7{H_2}S{O_4} \to 3F{e_2}{(S{O_4})_3} + {K_2}S{O_4} + C{r_2}{(S{O_4})_3} + 7{H_2}O\)
Từ PTHH suy ra 1 mol K2Cr2O7 tạo ra 3 mol Fe2(SO4)3
=> 2 mol K2Cr2O7 tạo ra 2.3 = 6 mol Fe2(SO4)3
Cho phản ứng chưa cân bằng:
\(C{u_2}S + HN{O_3} \to Cu{(N{O_3})_2} + {H_2}S{O_4} + NO + {H_2}O\)
Trong phương trình hoá học của phản ứng trên, khi hệ số của Cu2S là 6 thì hệ số của H2SO4 là
\(\begin{array}{*{20}{c}}3\\{10}\end{array}\left| {\begin{array}{*{20}{c}}{C{u_2}S \to \mathop {Cu}\limits^{ + 2} + \mathop S\limits^{ + 6} + 10e}\\{\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} }\end{array}} \right.\)
=> \(3C{u_2}S + 22HN{O_3} \to 6Cu{(N{O_3})_2} + 3{H_2}S{O_4} + 10NO + 8{H_2}O\)
Từ PTHH ta thấy 3 mol Cu2S tạo ra 3 mol H2SO4
=> 6 mol Cu2S tạo ra 6 mol H2SO4
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O.
Các hệ số a,b,c,d,e là những số nguyên, đơn giản nhất. Tổng (a+b) bằng:
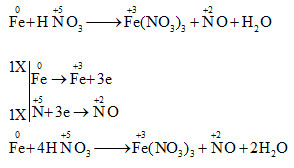
=> tổng hệ số a +b = 1 +4 = 5
Cho phản ứng chưa cân bằng:
\(KCl + KMn{O_4} + {H_2}S{O_4} \to C{l_2} + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Trong phương trình hoá học của phản ứng trên, tỉ lệ mol KMnO4/Cl2 là
\(K\mathop {Cl}\limits^{ - 1} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_4} \to \mathop {C{l_2}}\limits^0 + \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + {H_2}O\)
\(\left| {\begin{array}{*{20}{c}}{2\mathop {Cl}\limits^{ - 1} \to \mathop {C{l_2}}\limits^0 + 2e}\\{\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} }\end{array}} \right.\)
=> \(10KCl + 2KMn{O_4} + 8{H_2}S{O_4} \to 5C{l_2} + 2MnS{O_4} + 6{K_2}S{O_4} + 8{H_2}O\)
Từ PTHH => \(\dfrac{{{n_{KMn{O_4}}}}}{{{n_{C{l_2}}}}} = \dfrac{2}{5}\)
Cho các phản ứng hóa học sau:
aFeS + bHNO3 → cFe(NO3)3 + dH2SO4 + eNO + gH2O
Trong đó a, b, c, d, e, g là các số nguyên tối giản. Giá trị b là
\(\begin{array}{l}
1x\,\,\,\,\,\,\,FeS - 9e \to \mathop {Fe}\limits^{ + 3} + \mathop S\limits^{ + 6} \\
3x\,\,\,\,\,\,\,\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2}
\end{array}\)
FeS + 6HNO3 → Fe(NO3)3 + H2SO4 + 3NO + 2H2O
Phản ứng nào dưới đây không phải phản ứng oxi hoá – khử?
Sự thay đổi số oxi hoá của các nguyên tố trong lựa chọn
A là \(\mathop {Zn}\limits^0 + 2\mathop H\limits^{ + 1} Cl \to \mathop {Zn}\limits^{ + 2} C{l_2} + \mathop {{H_2}}\limits^0 .\)
B là $\mathop {F{e_2}}\limits^{ + 3} {O_3} + 2\mathop {Al}\limits^0 \xrightarrow{{{t^0}}}\mathop {A{l_2}}\limits^{ + 3} {O_3} + 2\mathop {Fe}\limits^0 .$
C là \(\mathop {Mg}\limits^0 + 2{H_2}\mathop S\limits^{ + 6} {O_4} \to \mathop {Mg}\limits^{ + 2} S{O_4} + \mathop S\limits^{ + 4} {O_2} + 2{H_2}O.\)
Phản ứng không phải phản ứng oxi hoá – khử là \(BaC{l_2} + {H_2}S{O_4} \to BaS{O_4} + 2HCl.\)
Cho các phản ứng sau:
(a) \(C{O_2} + Ca{(OH)_2} \to CaC{O_3} + {H_2}O.\)
(b) \(2Al + 2NaOH + 2{H_2}O \to 2NaAl{O_2} + 3{H_2}.\)
(c) ${(N{H_4})_2}S{O_4}\xrightarrow{{{t^o}}}2N{H_3} + {H_2}S{O_4}.$
(d) $CaC{O_3}\xrightarrow{{{t^o}}}CaO + C{O_2}.$
Số phương trình thuộc loại phản ứng oxi hoá – khử là
\(2\mathop {Al}\limits^0 + 2NaO\mathop H\limits^{ + 1} + 2{H_2}O \to 2Na\mathop {Al}\limits^{ + 3} {O_2} + 3\mathop {{H_2}}\limits^0 .\)
CS2 là nguyên liệu phổ biến dùng trong tổng hợp hoá hữu cơ của các ngành công nghiệp. CS2 dễ dàng bốc cháy trong oxygen theo phương trình:
\(C{S_2} + {O_2} \to C{O_2} + S{O_2}\)
Khi lấy 0,5 mol CS2 tác dụng với 1,2 mol O2 thì tổng số mol khí thu được sau phản ứng là
\(C{S_2} + 3{O_2} \to C{O_2} + 2S{O_2}\)
Xét tỉ lệ \(\dfrac{{{n_{C{S_2}}}}}{1} = \dfrac{{0,5}}{1} = 0,5 > \dfrac{{{n_{{O_2}}}}}{3} = \dfrac{{1,2}}{3} = 0,4\)=> CS2 dư, O2 hết => Tính toán theo O2
\(\begin{array}{*{20}{c}}{C{S_2}}\\{}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{3{O_2}}\\{1,2}\end{array}\begin{array}{*{20}{c}} \to \\{}\end{array}\begin{array}{*{20}{c}}{C{O_2}}\\{0,4}\end{array}\begin{array}{*{20}{c}} + \\{}\end{array}\begin{array}{*{20}{c}}{2S{O_2}}\\{0,8}\end{array}\)
=> Hỗn hợp sau phản ứng gồm CO2 (0,4 mol) và SO2 (0,8 mol)
=> Tổng số mol khí thu được sau phản ứng là 0,4 + 0,8 = 1,2 mol
Sodium percarbonate (Na2CO3.3H2O2) có tính oxi hoá nên được dùng làm chất tẩy trắng đa năng, thân thiện với môi trường như bột giặt đồ. Sodium percarbonate có tính chất kép của Na2CO3 và H2O2. Cho các dung dịch sau: MnO2, KMnO4, HCl loãng, Na2SO3 loãng. Số chất trong các chất trên phản ứng với sodium percarbonate thì sodium percarbonate chỉ bị khử?
Sodium percarbonate bị khử tức sodium percarbonate là chất oxi hoá trong phản ứng
KMnO4 và MnO2 là các chất oxi hoá => Loại
HCl là axit phản ứng với muối carbonate tạo khí CO2 => Đây là phản ứng trao đổi => Loại
\(3N{a_2}S{O_3} + N{a_2}C{O_3}.3{H_2}{O_2} \to 3N{a_2}S{O_4} + N{a_2}C{O_3} + 3{H_2}O\)
Cho phương trình phản ứng a Al + b HNO3 → c Al(NO3)3 + d NO + e H2O
Tỉ lệ b : c là
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Nên b : c = 4 : 1
Cho sơ đồ phản ứng sau:
\(N{H_3}\xrightarrow[{{t^0},xt}]{{ + {O_2}}}NO\xrightarrow{{ + {O_2}}}N{O_2}\xrightarrow{{ + {O_2} + {H_2}O}}HN{O_3}\xrightarrow{{ + CuO}}Cu{(N{O_3})_2}\xrightarrow{{{t^0}}}N{O_2}\)
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng oxi hóa - khử trong chuỗi trên là
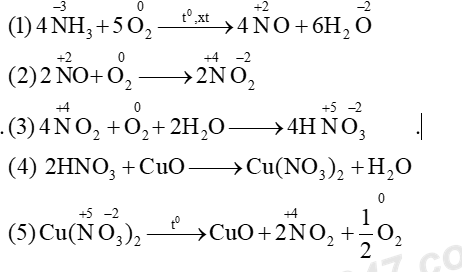
=> các phương trình (1), (2), (3) , (5) đều là phản ứng oxi hóa khử => có 4 phản ứng oxh - khử
Cho phương trình hoá học:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Trong phương trình trên, tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá-khử) là
Phân tử HCl bị oxi hóa tạo thành phân tử Cl2
=> Số phân tử HCl bị oxi hóa là 5.2 = 10
=> Số phân tử HCl môi trường là 16-10 = 6
Vậy tỉ lệ số phân tử HCl bị oxi hoá và số phân tử HCl làm môi trường (không oxi hoá-khử) là 10:6 = 5:3
Trong phản ứng : CuO + H2 → Cu + H2O
Chất oxi hóa là :
\(\begin{array}{l}
\mathop {Cu}\limits^{ + 2} + 2e \to \mathop {Cu}\limits^0 \\
{\mathop {H_2}\limits^0 } - 2e \to 2\mathop H\limits^{ + 1}
\end{array}\)
Vậy CuO là chất oxi hóa
Trong các phản ứng sau, phản ứng oxi hóa – khử là
Phản ứng oxi hóa khử là phản ứng mà trong đó có sự thay đổi số oxi hóa của một hay một số nguyên tố.
Phản ứng oxi hóa khử là:3Mg + 4H2SO4 →3MgSO4 + S + 4H2O
Cho phản ứng: aFe3O4 + bHNO3 → cFe(NO3)3 + dNO + eH2O. Trong đó, a, b, c, d, e là các số nguyên tối giản. Tổng a, b, c, d, e bằng
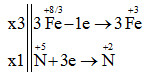
Vậy 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
a + b + c + d + e = 3 + 28 + 9 + 1 + 14 = 55

