Phương trình hóa học nào sau đây là phản ứng oxi hóa - khử?
Phản ứng Br2 + 2H2O + SO2 → 2HBr + H2SO4 là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Br (từ 0 xuống -1) và S (từ +4 lên +6).
Loại phản ứng nào sau đây luôn không phải là phản úng oxi hóa – khử ?
Phản ứng trao đổi không phải là phản ứng oxi hóa - khử.
Cho các phản ứng :
(a) Ca(OH)2 + CO2 → CaCO3 + H2O
(b) 2H2S + SO2 → 3S + 2H2O
(c) 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
(d) 4KClO3 → KCl + 3KClO4
Số phản ứng oxi hóa - khử là :
Các phản ứng oxi hóa – khử là (b), (c), (d)
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Chỉ có phản ứng 2HgO → 2Hg + O2 có sự thay đổi số oxi hóa
Trong phản ứng sau: Cl2 + 2H2O + SO2 → H2SO4 + 2HCl, thì :
\({\mathop {Cl_2}\limits^0 } + 2e \to 2\mathop {Cl}\limits^{ - 1} \) => Cl2 là chất oxi hóa
\(\mathop S\limits^{ + 4} - 2e \to \mathop S\limits^{ + 6} \) => SO2 là chất khử
Trong phản ứng: 4NH3 + 3O2 -> 2N2 + 6H2O. Vai trò của NH3 là
\(4\mathop N\limits^{ - 3} {H_3} + {\rm{ }}3{O_2} \to 2{\mathop {N_2}\limits^0 } + {\rm{ }}6{H_2}O\)
=>\(2\mathop N\limits^{ - 3} - 6e \to {\mathop {N_2}\limits^0 }\)
NH3 nhường e => NH3 là chất khử
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
Cho phản ứng : 2Na + Cl2 → 2NaCl. Trong phản ứng này, nguyên tử natri
\(\mathop {Na}\limits^0 - 1e \to \mathop {Na}\limits^{ + 1} \)
Na là chất khử hay chất bị oxi hóa
Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Sau khi cân bằng, tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là
Bước 1: Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng e
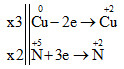
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Bước 2: Tính tổng hệ số tối giản các chất sản phẩm của phản ứng
Tổng hệ số cân bằng tối giản các chất sản phẩm trong phản ứng là: 3 + 2 + 4 = 9
Trong số các phản ứng sau, phản ứng nào là phản ứng oxi hóa - khử ?
Phản ứng 2HNO3 + 3H2S → 3S + 2NO + 4H2O là phản ứng oxi hóa khử vì có sự thay đổi số oxi hóa của N và S
Chất nào dưới đây thể hiện tính khử khi cho tác dụng với dung dịch H2SO4 loãng?
Chất khử là chất nhường e để lên mức oxi hóa cao hơn.
Fe + H2SO4 → FeSO4 + H2 => Fe thể hiện tính khử
Số oxi hóa của iron trong chất nào là lớn nhất?
Số oxi hóa của O trong các hợp chất thường là -2
Số oxi hóa của hợp chất bằng không
Số oxi hóa của hợp chất bằng tổng số oxi hóa của các nguyên tố
Với Fe2O3: Gọi số oxi hóa của iron trong hợp chất là x
⇒ 2.x+3.(-2)=0 ⇒ x=+3
Làm tương tự với các hợp chất còn lại thì thấy +3 là số oxi hóa cao nhất của Fe
Trong các phản ứng sau, phản ứng nào là phản ứng oxi hóa – khử?
Phản ứng oxi hóa – khử là phản ứng vừa có chất oxi hóa vừa có chất khử. Chất oxi hóa là chất nhận electron là HCl, chất khử là chất nhường electron là Fe
\(\mathop {Fe}\limits^0 + 2\mathop H\limits^{ + 1} Cl \to \mathop {Fe}\limits^{ + 2} C{l_2} + \mathop {{H_2}}\limits^0 \)
Cho phương trình hóa học: $3C{l_2} + 6KOH\xrightarrow{{{t^o}}}5KCl + KCl{O_3} + 3{H_2}O$. Chất Cl2 đóng vai trò
\(\mathop {C{l_2}}\limits^0 + 2e \to \mathop {2Cl}\limits^{ - 1} \): Cl2 nhận electron nên là chất oxi hóa
\(\mathop {C{l_2}}\limits^0 \to \mathop {2Cl}\limits^{ + 5} + 10e\): Cl2 nhường electron nên là chất khử
⇒ Cl2 trong phản ứng trên vừa là chất oxi hóa, vừa là chất khử
Cho phương trình của phản ứng sau:
\(F{e_x}{O_y} + {H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + S{O_2} + {H_2}O\)
Hệ số cân bằng của H2SO4 là
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\({\mathop {Fe}\limits^{ + 2y/x} _x}{O_y} + {H_2}\mathop S\limits^{ + 6} {O_4} \to {\mathop {Fe}\limits^{ + 3} _2}{(S{O_4})_3} + \mathop S\limits^{ + 4} {O_2} + {H_2}O\)
Do \(\mathop S\limits^{ + 6} \) trong H2SO4 xuống \(\mathop S\limits^{ + 4} \) trong SO2 nên H2SO4 là chất oxi hóa
⇒ FexOy là chất khử
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} }\\{\mathop {2xFe}\limits^{ + 2y/x} \to \mathop {2xFe}\limits^{ + 3} + (6x - 4y)e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
Bước 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2F{e_x}{O_y} + (6x - 2y){H_2}S{O_4} \to xF{e_2}{(S{O_4})_3} + (3x - 2y)S{O_2} + (6x - 2y){H_2}O\)
Đâu không phải đặc điểm của phản ứng oxi hóa – khử?
Chất khử là chất nhường electron
Thực hiện các thí nghiệm sau
a. Nung nóng KNO3
b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư
c. Sục khí Cl2 vào dung dịch FeCl2
d. Cho dung dịch KHSO4 vào dung dịch FeCl2
e. Cho Si vào dung dịch NaOH
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
(a) KNO3 KNO2 + ½ O2 → phản ứng oxh khử
(b) 2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O → phản ứng oxh khử
(c) Cl2 + 2FeCl2 → 2FeCl3 → phản ứng oxh khử
(d) KHSO4 + FeCl2 → không phản ứng
(e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 → Phản ứng oxh khử
Số thí nghiệm xảy ra phản ứng oxi hóa khử là 4
Cân bằng lại phương trình trên cho đúng, tổng hệ số cân bằng của các chất trong phương trình trên là
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\)
\({S^{ + 6}} + 8e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
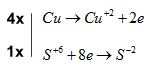
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(4Cu + 5{H_2}S{O_4} \to 4CuS{O_4} + {H_2}S + 4{H_2}O\)
⇒Tổng hệ số cân bằng của các chất trong phương trình trên là 4 + 5 + 4 + 1 + 4 = 18
Phương trình trên chưa được cân bằng do sai ở
Bước 2 ở quá trình khử
Sửa lại \({S^{ + 6}} + 8e \to {S^{ - 2}}\)
Nội dung của nguyên tắc thăng bằng electron mà bạn học sinh sử dụng ở trên là như thế nào?
Nội dung của nguyên tắc thăng bằng electron: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.

