Oxi hóa NH3 bằng CrO3 sinh ra N2 , H2O và Cr2O3. Số phân tử NH3 tác dụng với 1 phân tử CrO3 là :
Phản ứng : 2CrO3 + 2NH3 \(\xrightarrow{{{t^o}}}\) Cr2O3 + N2 + 3H2O
=> cứ 1 NH3 sẽ phản ứng với 1 CrO3
Trong phản ứng: \(N{O_2} + {H_2}O \to HN{O_3} + NO\), nguyên tố nitơ …
\(\mathop N\limits^{ + 4} {O_2} + {H_2}O \to H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\)
Trong phản ứng nào sau đây, HCl đóng vai trò là chất oxi hóa ?
Ở phản ứng: \(F{\rm{e}} + 2HCl \to F{\rm{e}}C{l_2} + {H_2}\)ta thấy HCl nhận e nên là chất oxi hóa
\(2{H^ + } + 2{\rm{e}} \to {H_2}\)
Phản ứng nào sau đây là phản ứng oxi hóa – khử ?
\(4\mathop N\limits^{ - 3} {H_3} + 3\mathop {{O_2}}\limits^0 \to 2{\mathop N\limits^0 _2} + 6{H_2}\mathop O\limits^{ - 2} \)
Cho quá trình NO3- + 3e + 4H+ → NO + 2H2O, đây là quá trình
Ta thấy quá trình trên là quá trình nhận e nên là quá trình khử.
Trong các chất: Fe3O4, HCl, FeSO4, Fe2(SO4)3, SO2. Số chất vừa có tính oxi hóa, vừa có tính khử là
Fe3O4: Fe có số oxi hóa +8/3 là số oxi hóa trung gian nên có tính khử và tính oxi hóa
HCl: H có số oxi hóa +1 có thể nhận e để lên 0, Cl có số oxi hóa -1 có thể cho e để lên mức oxi hóa cao hơn nên có tính khử và tính oxi hóa
FeSO4: Fe có số oxi hóa +2 là số oxi hóa trung gian nên có tính khử và tính oxi hóa
Fe2(SO4)3 chỉ có tính oxi hóa
SO2: S có số oxi hóa +4 là số oxi hóa trung gian nên có tính khử và oxi hóa
Phản ứng oxi hóa - khử là
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một hay nhiều nguyên tố
Cho phương trình hóa học của phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Nhận xét nào sau đây về phản ứng trên là đúng ?
Fe0 – 2e → Fe+2
Cu+2 + 2e → Cu0
Fe nhường e nên là chất khử
Cu2+ nhận e nên là chất oxi hóa
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A đúng vì Fe từ 0 lên +8/3 trong Fe3O4 => Fe là chất khử. O từ 0 trong O2 xuống -2 trong Fe3O4 => O2 là chất oxi hóa
Cho các phương trình phản ứng sau:
(1) $CaC{O_3}\xrightarrow{{{t^o}}}CaO + C{O_2}.$
(2) $CuO + {H_2}\xrightarrow{{{t^o}}}Cu + {H_2}O.$
(3) $A{l_2}{O_3} + 2Fe\xrightarrow{{{t^o}}}2Al + F{e_2}{O_3}.$
(4) \(C{l_2} + 2KOH \to KCl + KClO + {H_2}O.\)
Số lượng phương trình phản ứng thuộc phản ứng oxi hóa – khử là
(1) không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của nguyên tố
(2) là phản ứng oxi hóa – khử. Cu từ +2 trong CuO xuống 0 trong Cu => CuO là chất oxi hóa. H từ 0 trong H2 lên +1 trong H2O => H2 là chất khử
(3) là phản ứng oxi hóa – khử. Al từ +3 trong Al2O3 xuống 0 trong Al => Al2O3 là chất oxi hóa. Fe từ 0 lên +3 trong Fe2O3 => Fe là chất khử
(4) là phản ứng oxi hóa – khử. Cl từ 0 trong Cl2 đồng thời xuống -1 trong KCl và lên +1 trong KClO => Cl2 vừa là chất oxi hóa vừa là chất khử
=> Các phương trình phản ứng oxi hóa – khử là (2), (3) và (4)
Khí đốt hóa lỏng thường gọi là gas, có thành phần gồm propane (C3H8) và butane (C4H10). Xét phản ứng đốt cháy propane và butane khi đun bếp gas:
(1) ${C_3}{H_8} + {O_2}\xrightarrow{{{t^o}}}C{O_2} + {H_2}O$
(2) ${C_4}{H_{10}} + {O_2}\xrightarrow{{{t^o}}}C{O_2} + {H_2}O$
Phát biểu nào sau đây không đúng?
Các nguyên tử thay đổi số oxi hóa trong cả hai phương trình là C và O
\(\begin{array}{*{20}{c}}{1x}\\{\mathop {5x}\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {{C_3}}\limits^{ - 8/3} \to 3\mathop C\limits^{ + 4} + 20e}\\{\mathop {{O_2}}\limits^0 + 4e \to 2\mathop O\limits^{ - 2} }\end{array}} \right.\) => Phương trình cân bằng của (1) là: ${C_3}{H_8} + 5{O_2}\xrightarrow{{{t^o}}}3C{O_2} + 4{H_2}O$
\(\begin{array}{*{20}{c}}{2x}\\{\mathop {13x}\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {{C_4}}\limits^{ - 5/2} \to 4\mathop C\limits^{ + 4} + 26e}\\{\mathop {{O_2}}\limits^0 + 4e \to 2\mathop O\limits^{ - 2} }\end{array}} \right.\) => Phương trình cân bằng của (2) là: $2{C_4}{H_{10}} + 13{O_2}\xrightarrow{{{t^o}}}8C{O_2} + 10{H_2}O$
A đúng vì O2 nhận electron (hoặc O2 có O biến đổi từ số oxi hóa cao xuống thấp)
B đúng
C sai.
Từ phương trình cân bằng của (1) => Số mol O2 cần dùng khi đốt cháy 1 mol C3H8 là 5 mol
Từ phương trình cân bằng của (2) => Số mol O2 cần dùng khi đốt cháy 1 mol C4H10 là 13/2 mol
=> Số mol O2 cần dùng của (2) gấp 1,3 số mol O2 cần dùng của (1)
D đúng. Số electron nhường của (1) là 20 electron, số electron nhường của (2) là 26 electron
Cho phương trình hóa học sau:
FeS2 + KNO3 + KHSO4 → Fe2(SO4)3 + K2SO4 + NO + H2O.
Tổng hệ số (số nguyên, tối giản) của tất cả các chất phản ứng trong phương trình trên là
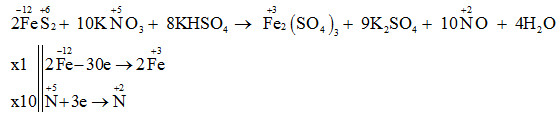
Tổng hệ số (số nguyên, tối giản) của tất cả các chất phản ứng trong phương trình trên là 2+10+8 = 20
Cho các chất sau: Mn, MnO2, MnSO4, KMnO4. Chiều sắp xếp giảm dần về số oxi hóa của nguyên tử Mn trong các chất trên là
Mn có số oxi hóa là 0
MnO2: Mn có số oxi hóa là +4
MnSO4: Mn có số oxi hóa là +2
KMnO4: Mn có số oxi hóa là +7
=> Chiều sắp xếp giảm dần về số oxi hóa của Mn trong các chất trên là: KMnO4, MnO2, MnSO4, Mn
Chlorine vừa là chất oxi hóa, vừa là chất khử trong phản ứng nào sau đây?
A có chất khử là FeCl2 (vì Fe từ +2 trong FeCl2 lên +3 trong FeCl3), chất oxi hóa là Cl2 (vì Cl từ 0 trong Cl2 xuống -1 trong FeCl3)
B có chất khử là Cl2 (vì Cl từ 0 trong Cl2 lên +5 trong KClO3), chất oxi hóa là Cl2 (vì Cl từ 0 trong Cl2 xuống -1 trong KCl)
C có chất khử là NaCl (vì Cl từ -1 trong NaCl lên 0 trong Cl2), chất oxi hóa là H2O (vì H từ +1 trong H2O xuống 0 trong H2)
D có chất khử là KClO3 (vì O từ -2 trong KClO3 lên 0 trong O2), chất oxi hóa là KClO3 (vì Cl từ +5 trong KClO3 xuống -1 trong KCl)
Cho các phương trình phản ứng hóa học sau:
\(\begin{array}{l}(a)S{O_3} + {H_2}O \to {H_2}S{O_4}\\(b)CaC{O_3} + 2HCl \to CaC{l_2} + C{O_2} + {H_2}O\\(c)2C{O_2} + Ca{(OH)_2} \to Ca{(HC{O_3})_2}\\(d)2Na + 2{H_2}O \to 2NaOH + {H_2}\end{array}\)
$(e)C + {H_2}O\xrightarrow{{{t^o}}}CO + {H_2}$
$(g)2KMn{O_4}\xrightarrow{{{t^o}}}{K_2}Mn{O_4} + Mn{O_2} + {O_2}$
Số phương trình thuộc phản ứng oxi hóa – khử là
Phản ứng oxi hóa – khử là phương trình phản ứng (d), (e) và (g) vì có sự thay đổi số oxi hóa của các nguyên tử nguyên tố
\((d)2\mathop {Na}\limits^0 + 2\mathop {{H_2}}\limits^{ + 1} O \to 2\mathop {Na}\limits^{ + 1} OH + \mathop {{H_2}}\limits^0 \)
$(e)\mathop C\limits^0 + \mathop {{H_2}}\limits^{ + 1} O\xrightarrow{{{t^o}}}\mathop C\limits^{ + 2} O + \mathop {{H_2}}\limits^0 $
$(g)2K\mathop {Mn}\limits^{ + 7} \mathop {{O_4}}\limits^{ - 2} \xrightarrow{{{t^o}}}{K_2}\mathop {Mn}\limits^{ + 6} {O_4} + \mathop {Mn}\limits^{ + 4} {O_2} + \mathop {{O_2}}\limits^0 $
Phản ứng oxi hóa – khử là phản ứng
Phản ứng oxi hóa – khử là phản ứng có kèm theo sự thay đổi số oxi hóa.
Phản ứng oxi hoá - khử xảy ra theo chiều tạo chất nào sau đây?
Phản ứng oxi hoá - khử xảy ra theo chiều tạo chất oxi hoá yếu hơn và chất khử yếu hơn.
Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. Phương trình hoá học: 4NH3 + 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò
$4\overset{-3}{\mathop{N}}\,{{H}_{3}}+\text{ }5{{\overset{0}{\mathop{O}}\,}_{2}}\to 4\overset{+2}{\mathop{N}}\,\overset{-2}{\mathop{O}}\,\text{ }+\text{ }6{{H}_{2}}O$
Quá trình cho – nhận e của N:
$\mathop N\limits^{ - 3} {\mkern 1mu} {H_3}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\text{}} \to {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} \mathop N\limits^{ + 2} {\mkern 1mu} O{\mkern 1mu} {\mkern 1mu} $ + 5e
=> NH3 đóng vai trò là chất khử.
Cho phương trình hóa học : 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Kết luận nào sau đây là đúng?
$4\overset{+2}{\mathop{Fe}}\,{{\left( OH \right)}_{2}}~+~{{\overset{0}{\mathop{O}}\,}_{2}}~+\text{ }2{{H}_{2}}O\text{ }\to \text{ }4\overset{+3}{\mathop{Fe}}\,{{(\overset{-2}{\mathop{O}}\,H)}_{3}}.$
Quá trình cho – nhận e:
$\overset{+2}{\mathop{Fe}}\,~\,\,\to \text{ }\overset{+3}{\mathop{Fe}}\,\,\,+\,\,1\text{e}$ => Fe(OH)2 là chất khử
${{\overset{0}{\mathop{O}}\,}_{2}}~+\text{ 4e }\to \text{ 2}\overset{-2}{\mathop{O}}\,$ => O2 là chất oxi hóa
Cho ba phản ứng hóa học dưới đây
1) 2Na + 2H2O → 2NaOH + H2↑
2) CO2 + Ca(OH)2 → CaCO3↓ + H2O
3) 2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
Các phản ứng oxi hóa khử là
Phản ứng oxi hóa – khử làm thay đổi số oxi hóa của các chất
=> có 2 phản ứng oxi hóa khử là
$\begin{align} & 1)~2\overset{0}{\mathop{Na}}\,~+~2{{\overset{+1}{\mathop{H}}\,}_{2}}{{O}_{{}}}\to \text{}2\overset{+1}{\mathop{Na}}\,OH~+{{\overset{0}{\mathop{~H}}\,}_{2}} \\ & 3)\text{ }2K\overset{+5}{\mathop{Cl}}\,{{\overset{-2}{\mathop{O}}\,}_{3}}~\to 2K\overset{1}{\mathop{Cl}}\,~+\text{ }3{{\overset{0}{\mathop{O}}\,}_{2}} \\ \end{align}$

